Lý Thuyết Sự ăn Mòn Kim Loại (mới 2022 + Bài Tập) - Hóa Học 12
Có thể bạn quan tâm
Lý thuyết Hoá 12 Bài 20: Sự ăn mòn kim loại
Bài giảng Hoá 12 Bài 20: Sự ăn mòn kim loại
I. Khái niệm
- Sự ăn mòn kim loại là sự phá hủy kim loại hoặc hợp kim dưới tác dụng của môi trường xung quanh. Đó là một quá trình hóa học hoặc quá trình điện hóa trong đó kim loại bị oxi hóa thành ion dương:
M → Mn+ + ne
II. Các dạng ăn mòn kim loại
Có hai dạng ăn mòn kim loại là ăn mòn hóa học và ăn mòn điện hóa học.
1. Ăn mòn hóa học
a. Nguyên nhân: do kim loại có phản ứng hóa học trực tiếp với các chất ở môi trường xung quanh.
Ví dụ: Ngâm dinh sắt trong dung dịch H2SO4 loãng
Fe + H2SO4 (loãng) → FeSO4 + H2

Sắt tác dụng với H2SO4 loãng
b. Điều kiện: kim loại được đặt trong môi trường có chứa chất oxi hóa mà kim loại có thể tham gia phản ứng thường là chất khí, hơi nước, dung dịch axit...
c. Bản chất: là quá trình oxi hóa - khử trong đó kim loại đóng vai trò chất khử. Electron chuyển trực tiếp từ kim loại vào môi trường.
2. Ăn mòn điện hóa học
a. Khái niệm
- Ăn mòn điện hóa học là quá trình oxi hóa -khử, trong đó kim loại bị ăn mòn do tác dụng của dung dịch chất điện li và tạo nên dòng electron chuyển dời từ cực âm đến cực dương.
- Ví dụ: Nhúng thanh Zn và thanh Cu (không tiếp xúc trực tiếp với nhau) vào cốc đựng dung dịch H2SO4 loãng. Nối thanh kẽm với thanh đồng bằng dây dẫn cho đi qua một điện kế, như hình minh họa sau:
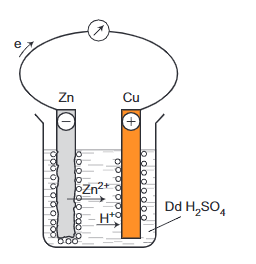
- Hiện tượng:
+ Khi chưa nối dây dẫn, lá Zn bị hòa tan và bọt khí H2 thoát ra ở bề mặt lá Zn.
+ Khí nối dây dẫn, lá Zn bị ăn mòn nhanh trong dung dịch điện li, kim điện kế lệch, bọt khí H2 thoát ra cả ở lá Cu.
- Giải thích:
+ Khi chưa nối dây dẫn, kẽm bị ăn mòn hóa học do phản ứng oxi hóa kẽm bởi ion H+ trong dung dịch axit:
Zn + 2H+ → Zn2+ + H2
Bọt khí sinh ra trên bề mặt lá Zn.
+ Khi nối các thanh Cu và Zn bằng một dây dẫn, một pin điện đã được hình thành, trong đó Zn là cực âm, Cu là cực dương.
Tại cực âm (anot), kẽm bị ăn mòn theo phản ứng:
Zn → Zn2+ + 2e
Tại cực dương (catot), ion H+ của dung dịch H2SO4 nhận electron biến thành H rồi thành phân tử H2 thoát ra:
2H+ + 2e → H2
+ Các electron di chuyển từ lá Zn sang lá Cu qua dây dẫn tạo ra dòng điện một chiều. Dòng điện này làm cho kim điện kế bị lệch.
b. Điều kiện xảy ra sự ăn mòn điện hóa học
+ Các điện cực phải khác nhau về bản chất, có thể là 2 cặp kim loại khác nhau hoặc cặp kim loại với phi kim….
+ Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn.
+ Các điện cực phải cùng tiếp xúc với một dung dịch chất điện li.
⇒ Thiếu một trong 3 điều kiện trên sẽ không xảy ra ăn mòn điện hóa học.
Trong tự nhiên, sự ăn mòn kim loại xảy ra phức tạp, có thể xảy ra đồng thời cả ăn mòn hóa học và ăn mòn điện hóa học.
III. Chống ăn mòn kim loại
Sự ăn mòn kim loại gây tổn thất to lớn cho nền kinh tế quốc dân. Để bảo vệ kim loại khỏi sự ăn mòn có thể sử dụng các phương pháp sau:
1. Phương pháp bảo vệ bề mặt
Dùng những chất bền vững với môi trường để phủ ngoài mặt những đồ vật bằng kim loại như bôi dầu, mỡ, sơn, mạ, tráng men…

Sơn chống gỉ
2. Phương pháp điện hóa
- Nối kim loại cần bảo vệ với một kim loại hoạt động hơn để tạo thành pin điện hóa và kim loại hoạt động hơn bị ăn mòn, kim loại kia được bảo vệ.
- Ví dụ để bảo vệ vỏ tàu biển bằng thép, người ta gắn các lá Zn vào phía ngoài vỏ tàu ở phần chìm trong nước biển (nước biển là dung dịch chất điện li). Phần vỏ tàu bằng thép là cực dương, các lá Zn là cực âm.
+ Ở anot (cực âm): Zn bị oxi hóa Zn → Zn2+ + 2e
+ Ở catot (cực dương): O2 bị khử 2H2O + O2 + 4e → 4OH-
- Kết quả vỏ tàu bị bảo vệ, Zn là vật hi sinh, nó bị ăn mòn. Nhưng tốc độ ăn mòn điện hóa của Zn trong điều kiện này tương đối nhỏ và vỏ tàu được bảo vệ trong thời gian dài. Sau một thời gian người ta thay những lá Zn bị ăn mòn thành những lá Zn khác.
Trắc nghiệm Hóa học 12 Bài 20: Ăn mòn kim loại
Câu 1:Trường hợp nào sau đây, kim loại bị ăn mòn điện hóa học?
A. Kim loại sắt trong dung dịch HNO3loãng.
B.Thép cacbon để trong không khí ẩm.
C.Đốt dây sắt trong khí oxi khô.
D.Kim loại kẽm trong dung dịch HCl.
Hiển thị đáp ánĐáp án: B
Giải thích:
Thép cacbon để trong không khí ẩm bị ăn mòn điện hóa
Tại anot (-) Fe → Fe2++ 2e
Tại catot (+) O2+ 2H2O + 4e → 4OH-
Các đáp án còn lại kim loại bị ăn mòn hóa học.
Câu 2:Có 4 dung dịch riêng biệt: a) HCl, b) CuCl2, c) FeCl3, d) HCl có lẫn CuCl2.
Nhúng vào mỗi dung dịch một thanh Fe nguyên chất. Số trường hợp xuất hiện ăn mòn điện hóa là
A. 0
B.1
C.2
D.3
Hiển thị đáp ánĐáp án: C
Giải thích:
Ăn mòn điện hóa học xảy ra khi thỏa đủ 3 điều kiện sau:
- Các điện cực phải khác nhau về bản chất.
- Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn.
- Các điện cực cùng tiếp xúc với dung dịch chất điện li.
a) Chỉ xảy ra ăn mòn hóa học:
Fe + 2HCl → FeCl2 + H2↑.
b) Ban đầu Fe bị ăn mòn hóa học:
Fe + CuCl2 → FeCl2 + Cu.
Cu sinh ra bám trực tiếp lên Fe
→ Xảy ra ăn mòn điện hóa đồng thời với ăn mòn hóa học.
c) Chỉ xảy ra ăn mòn hóa học:
Fe + 2FeCl3 → 3FeCl2.
d) Do H+H2>Cu2+Cu
→ Fe tác dụng với Cu2+ trước:
Fe + CuCl2 → FeCl2 + Cu.
Cu sinh ra bám trực tiếp lên Fe
→ xảy ra ăn mòn điện hóa đồng thời với ăn mòn hóa học.
→ Vậy có 2 trường hợp xuất hiện ăn mòn điện hóa là b) và d)
Câu 3:Một đồng xu bằng đồng rơi trên một miếng thép. Sau một thời gian có thể quan sát được hiện tượng nào sau đây?
A.Trên miếng thép xuất hiện lớp gỉ màu nâu đỏ.
B. Trên miếng thép xuất hiện lớp gỉ màu xanh lam.
C.Trên miếng thép xuất hiện lớp gỉ màu đen,
D.Trên miếng thép xuất hiện lớp gỉ màu trắng xanh.
Hiển thị đáp ánĐáp án: A
Giải thích: Sắt bị ăn mòn điện hoá tạo gỉ sắt màu nâu đỏ
Câu 4:Cho các phát biểu sau đây về ăn mòn hoá học:
(1) Ăn mòn hoá học không làm phát sinh dòng điện một chiều.
(2) Kim loại tinh khiết không bị ăn mòn hoá học.
(3) Về bản chất, ăn mòn hoá học cũng là một dạng của ăn mòn điện hoá.
(4) Ăn mòn hoá học là quá trình oxi hoá-khử.
Trong các phát biểu trên, số phát biểu đúng là
A.1.
B.2.
C. 3.
D. 4.
Hiển thị đáp ánĐáp án: B
Giải thích: Các phát biểu đúng (1) và (4)
Câu 5:Cho các cặp kim loại nguyên chất tiếp xúc trực tiếp với nhau: Fe và Pb; Fe và Zn; Fe và Sn; Fe và Ni. Khi nhúng các cặp kim loại trên vào dung dịch axit, số cặp kim loại trong đó Fe bị phá hủy trước là
A.1.
B. 2.
C.3.
D. 4.
Hiển thị đáp ánĐáp án: C
Giải thích:
Trong ăn mòn điện hóa, kim loại có tính khử mạnh hơn luôn bị ăn mòn trước và là cực âm (anot).
Các cặp Fe và Pb, Fe và Sn, Fe và Ni. Sắt hoạt động hơn nên sẽ đóng vai trò là cực âm, bị phá huỷ trước
Câu 6:Phản ứng điện phân dung dịch CuCl2(với điện cực trơ) và phản ứng ăn mòn điện hóa xảy ra khi nhúng hợp kim Zn - Cu vào dung dịch HCl có đặc điểm là:
A.Phản ứng ở cực âm có sự tham gia của kim loại hoặc ion kim loại.
B. Phản ứng ở cực dương đều là sự oxi hóa Cl-.
C. Đều sinh ra Cu ở cực âm.
D. Phản ứng xảy ra luôn kèm theo sự phát sinh dòng điện.
Hiển thị đáp ánĐáp án: A
Giải thích:
- Điện phân dung dịch CuCl2(với điện cực trơ)
+ Cực âm (catot) có Cu2+điện phân sinh ra Cu
Cu2++ 2e → Cu
+ Cực dương (catot) diễn ra sự oxi hóa Cl-
2Cl-→ Cl2+ 2e
+ Phản ứng không phát sinh ra dòng điện mà chỉ diễn ra nhờ tác dụng của dòng điện.
- Ăn mòn điện hóa khi nhúng hợp kim Zn - Cu vào dung dịch HCl
+ Cực âm (anot) Zn bị hòa tan
Zn → Zn2++ 2e
+ Cực dương (catot) diễn ra sự khử H+
2H++ 2e → H2
+ Không sinh ra Cu
+ Phản ứng phát sinh ra dòng điện 1 chiều.
Câu 7:Câu nào đúng trong các câu sau khi nói về ăn mòn điện hóa xảy ra:
A.Sự oxi hóa ở cực dương
B.Sự oxi hóa ở cực dương và sự khử ở cực âm
C.Sự khử ở cực âm
D.Sự oxi hóa ở cực âm và sự khử ở cực dương
Hiển thị đáp ánĐáp án: D
Giải thích: Kim loại thường bị oxi hóa thành ion kim loại ở cực âm (anot).
Câu 8:Trường hợp nào sau đây là ăn mòn điện hoá ?
A.Thép bị gỉ trong không khí ẩm.
B.Nhôm bị thụ động hoá trong HNO3đặc nguội,
C.Zn bị phá huỷ trong khí Cl2.
D. Na cháy trong không khí ẩm.
Hiển thị đáp ánĐáp án: A
Giải thích:
Thép bị gỉ trong không khí ẩm là ăn mòn điện hóa
Tại anot (-): Fe → Fe2++ 2e
Tại catot (+): O2+ 2H2O + 4e → 4OH-
Ion Fe2+tan vào dung dịch chất điện li có hòa tan khí O2. Tại đây, ion Fe2+tiếp tục bị oxi hóa, dưới tác dụng của ion OH-tạo ra gỉ sắt có thành phần chủ yếu là Fe2O3.nH2O
Câu 9: “Ăn mòn kim loại” là sự phá huỷ kim loại do:
A.Tác dụng hoá học của môi trường xung quanh.
B.Kim loại tác dụng với dung dịch chất điện ly tạo nên dòng diện.
C.Kim loại phản ứng hoá học với chất khí hoặc hơi nước ở nhiệt độ cao.
D.Tác động cơ học.
Hiển thị đáp ánĐáp án: A
Giải thích: “Ăn mòn kim loại” là sự phá hủy kim loại do tác dụng hóa học của môi trường xung quanh.
Câu 10:Có 4 dung dịch riêng biệt: CuSO4, ZnCl2, FeCl3, AgNO3. Nhúng vào mỗi dung dịch một thanh Ni. Số trường hợp xuất hiện ăn mòn điện hóa là
A. 1
B. 4
C. 3
D. 2
Hiển thị đáp ánĐáp án: D
Giải thích:
+) CuSO4: Ban đầu xảy ra ăn mòn hóa học
Ni + CuSO4→ NiSO4+ Cu
Sau đó ảy ra ăn mòn điện hóa. Hai điện cực là Ni và Cu, dung dịch chất điện li là CuSO4
+) ZnCl2: Không xảy ra ăn mòn hóa học vì Ni có tính khử yếu hơn Zn nên không đẩy được Zn ra khỏi muối để xuất hiện hai điện cực kim loại.
+) FeCl3: Không xảy ra ăn mòn hóa học vì
Ni + 2FeCl3→ NiCl2+ 2FeCl2
Không có hai điện cực.
+) AgNO3: Ban đầu xảy ra ăn mòn hóa học
Ni + 2AgNO3→ Ni(NO3)2+ 2Ag
Sau đó ảy ra ăn mòn điện hóa. Hai điện cực là Ni và Ag, dung dịch chất điện li là AgNO3
Xem thêm các bài tổng hợp lý thuyết Hóa học lớp 12 đầy đủ, chi tiết khác:
Lý thuyết Bài 21: Điều chế kim loại
Lý thuyết Bài 22: Luyện tập tính chất của kim loại
Lý thuyết Bài 23: Luyện tập Điều chế kim loại và sự ăn mòn kim loại
Lý thuyết Bài 1: Este
Lý thuyết Bài 2: Lipit
Từ khóa » Thứ Tự ăn Mòn Kim Loại
-
Sự ăn Mòn Kim Loại (Có Bài Tập áp Dụng)
-
Câu Hỏi Lý Thuyết Dãy điện Hóa - ăn Mòn Kim Loại
-
Ăn Mòn Kim Loại Là Gì? - Vina Trade Synergy
-
Sự ăn Mòn Kim Loại, ăn Mòn Hóa Học, ăn Mòn điện Hóa Và Cách Bảo ...
-
Bài 20: Sự ăn Mòn Kim Loại - Gia Sư Tâm Tài Đức
-
Ăn Mòn điện Hóa, ăn Mòn Hóa Học Là Gì?
-
[TOPIC] DÃY ĐIỆN HÓA VÀ ĂN MÒN KIM LOẠI - HOCMAI Forum
-
Ăn Mòn Kim Loại - Bảo Dưỡng Cơ Khí
-
Ăn Mòn Kim Loại Và Các Phương Pháp Bảo Vệ
-
Chương 5. Đại Cương Về Kim Loại-Bài 21. Sự ăn Mòn Kim Loại - LỚP 12
-
Phân Loại ăn Mòn Kim Loại
-
Sự ăn Mòn Kim Loại Là Gì? Cách Bảo Vệ Kim Loại Không Bị ăn Mòn?