Muối Cacbonat: Định Nghĩa, Tính Chất, ứng Dụng Phổ Biến - Monkey
Có thể bạn quan tâm
Đăng ký nhận tư vấn về sản phẩm và lộ trình học phù hợp cho con ngay hôm nay!
*Vui lòng kiểm tra lại họ tên *Vui lòng kiểm tra lại SĐT *Vui lòng kiểm tra lại Email Học tiếng Anh cơ bản (0-6 tuổi) Nâng cao 4 kỹ năng tiếng Anh (3-11 tuổi) Học Toán theo chương trình GDPT Học Tiếng Việt theo chương trình GDPT *Bạn chưa chọn mục nào! Đăng Ký Ngay X
ĐĂNG KÝ NHẬN TƯ VẤN THÀNH CÔNG!
Monkey sẽ liên hệ ba mẹ để tư vấn trong thời gian sớm nhất! Hoàn thành X
ĐÃ CÓ LỖI XẢY RA!
Ba mẹ vui lòng thử lại nhé! Hoàn thành X Bé học tiếng Anh dễ dàng cùng Monkey Junior Nhận tư vấn về chương trình Hết hạn sau 00 Ngày 00 Giờ 00 Phút 00 Giây *Vui lòng kiểm tra lại họ tên *Vui lòng để lại tuổi *Vui lòng kiểm tra lại SĐT Bạn là phụ huynh hay học sinh ? Học sinh Phụ huynh *Vui lòng chọn vai trò *Bạn chưa chọn mục nào! Nhận tư vấn miễn phí x
x 
Đăng ký nhận bản tin mỗi khi nội dung bài viết này được cập nhật
*Vui lòng kiểm tra lại Email Đăng Ký- Trang chủ
- Ba mẹ cần biết
- Giáo dục
- Kiến thức cơ bản
 Kiến thức cơ bản Muối cacbonat: Khái niệm, phân loại, tính chất và ứng dụng
Kiến thức cơ bản Muối cacbonat: Khái niệm, phân loại, tính chất và ứng dụng .png) Tham vấn bài viết:
Tham vấn bài viết: .png) Hoàng Mỹ Hạnh
Hoàng Mỹ Hạnh Thạc sĩ Ngôn ngữ - Chuyên gia Giáo dục sớm
Tác giả: Đào Vân
Ngày cập nhật: 27/05/2022
Nội dung chính
Muối cacbonat phân chia thành nhiều loại khác nhau với những tính chất và ứng dụng cụ thể. Cùng Monkey tìm hiểu chi tiết về loại muối này và giải các bài tập trong SGK qua bài viết dưới đây.
.png)
Khái niệm muối cacbonat là gì?
Muối cacbonat là muối của axit cacbonic, nó gồm 2 loại nhỏ là muối cacbonat CO32- và hidrocacbonat HCO3-. Muối cacbonat rất phổ biến và có nhiều ứng dụng trong cuộc sống như làm nguyên liệu sản xuất vôi, xi măng, xà phòng, thuốc chữa bệnh…

Phân loại muối cacbonat
Muối cacbonat được phân loại thành 2 loại chính bao gồm cacbonat trung hòa và cacbonat axit.
-
Muối cacbonat trung hòa: Được gọi là muối cacbonat, không còn nguyên tố H trong thành phần gốc axit. Ví dụ như: Magie cacbonat (MgCO3), canxi cacbonat (CaCO3), natri cacbonat (Na2CO3)…
-
Muối cacbonat axit: Được gọi là muối hidrocacbonat, nghĩa là chúng có nguyên tố H trong thành phần gốc axit. Ví dụ như natri hidrocacbonat NaHCO3; canxi hidrocacbonat (Ca(HCO3)2, kali hidrocacbonat (KHCO3)…
Tính tan của muối cacbonat
Đa phần, các muối cacbonat không tan trong nước, trừ một số muối cacbonat của kim loại kiềm như Na2CO3, K2CO3… Ngược lại, hầu hết muối hidrocacbonat tan trong nước ví dụ như Mg(HCO3)2, Ca(HCO3)2…
Tính chất hóa học của muối cacbonat
Muối cacbonat có những tính chất hóa học điển hình như tác dụng với dung dịch axit mạnh, tác dụng với dung dịch bazơ, tác dụng với dung muối, dễ bị nhiệt phân hủy giải phóng khí CO2 (trừ Na2CO3, K2CO3…). Cụ thể:

Muối cacbonat tác dụng với axit
Muối cacbonat có khả năng tác dụng với axit mạnh hơn axit cacbonic tạo thành muối mới và giải phóng khí CO2.
Để chứng minh cho tính chất hóa học này của muối cacbonat, SGK Hóa học 9 đã nêu thí nghiệm cụ thể cho dung dịch NaHCO3 và Na2CO3 lần lượt tác dụng với dung dịch axit clohidric (HCl). Quan sát thí nghiệm ta thấy có hiện tượng bọt khí thoát ra ở cả 2 ống nghiệm. Điều này xảy ra do phản ứng hóa học:
NaHCO3 (dd) + HCl (dd) -> NaCl (dd) + H2O (l) + CO2 (k)
Na2CO3 (dd) + 2HCl (dd) -> 2NaCl (dd) + H2O(l) + CO2 (k)
Tác dụng với dung dịch bazơ
Một số dung dịch muối cacbonat phản ứng với dung dịch bazơ tạo thành muối cacbonat không tan và bazơ mới
Ví dụ:
K2CO3 (dd) + Ca(OH)2 (dd) -> CaCO3 (rắn – trắng) + 2KOH (dd)
Lưu ý: Muối hidrocacbonat tác dụng với dung dịch kiềm sẽ tạo thành muối trung hòa và nước.
Ví dụ:
NaHCO3 (dd) + NaOH (dd) -> Na2CO3 (dd) + H2O (l)
Tác dụng với dung dịch muối
Dung dịch muối cacbonat có thể tác dụng với một số dung dịch muối khác, kết quả tạo ra 2 muối mới.
Ví dụ: Thực hiện thí nghiệm cho dung dịch natri cacbonat (Na2CO3) tác dụng với dung dịch canxi clorua (CaCl2) thấy có hiện tượng vẩn đục hoặc kết tủa trắng xuất hiện. Ta có phương trình phản ứng như sau:
Na2CO3 (dd) + CaCl2 (dd) -> CaCO3 (rắn – trắng) + 2NaCl (dd)
Phản ứng phân hủy muối cacbonat
Nhiều muối cacbonat, trừ muối cacbonat trung hòa của kim loại kiềm rất dễ bị nhiệt phân hủy giải phóng khí cacbonic. Ví dụ:
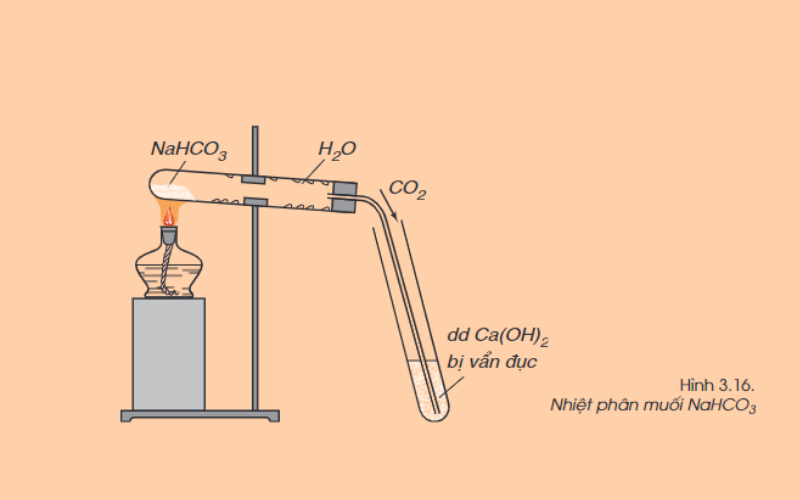
CaCO3 (r) -> nhiệt độ CaO (r) + CO2 (k)
2NaHCO3 (r) -> nhiệt độ Na2CO3 (r) + H2O (h) + CO2 (k)
Xem thêm:
- Muối là gì? Tổng hợp kiến thức từ A-Z và bài tập thực hành
- Muối kali nitrat (KNO3): Định nghĩa, tính chất, cách điều chế và ứng dụng
- Cacbon oxit (CO) là gì? Tính chất và các ứng dụng phổ biến
Ứng dụng muối cacbonat trong đời sống và sản xuất
Muối cacbonat có nhiều ứng dụng trong đời sống thực tiễn cũng như trong sản xuất công nghiệp. Mỗi muối cacbonat cụ thể lại có những ứng dụng riêng:

| Tên muối | Ứng dụng |
| CaCO3 (canxi cacbonat) | Ứng dụng trong công nghiệp xây dựng như cẩm thạch, đá xây dựng, thành phần cấu thành của xi măng. Ứng dụng trong ngành sơn, canxi cacbonat được sử dụng như chất độn chính. Ứng dụng làm tấm trần, khung nhựa, ống PVC… |
| Na2CO3 (natri cacbonat) | Nguyên liệu sản xuất thủy tinh (chiếm 13-15%) Làm chất phụ gia trong xà phòng, chất tẩy rửa. Nguyên liệu cho nhiều sản phẩm hóa chất gốc natri. |
| NaHCO3 (natri bicarbonat - baking soda) | Tạo độ giòn, xốp và làm đẹp cho bánh. Tạo bọt và tăng PH trong một số loại thuốc như thuốc nhức đầu. Giải quyết các vấn đề răng miệng như phòng ngừa sâu răng, mòn răng, bệnh nha chu… Ứng dụng làm các chế phẩm trung hòa acid dịch vị chữa bệnh trào ngược dạ dày… |
Bài tập về muối cacbonat SGK Hóa học 9 kèm lời giải
Một số bài tập về muối cacbonat để các bạn ôn tập lại kiến thức lý thuyết và áp dụng thực hành:

Bài tập 2 SGK Hóa học 9, trang 91
Dựa vào tính chất hóa học của muối cacbonat, hãy nêu tính chất của muối MgCO3 và viết các phương trình hóa học minh họa.
Gợi ý đáp án:
MgCO3 có tính chất của muối cacbonat.
-
Tác dụng với dung dịch axit:
MgCO3 + H2SO4 → MgSO4 + CO2 ↑ + H2O.
-
MgCO3 không tan trong nước, không tác dụng với dung dịch muối và dung dịch bazơ.
-
Dễ bị phân hủy:
MgCO3 -> (nhiệt độ) MgO + CO2.
Bài tập 3 SGK Hóa học 9, trang 91
Viết các phương trình hóa học biểu diễn chuyển hóa sau:
C -> CO2 -> CaCO3 -> CO2
Gợi ý đáp án:
Các phương trình hóa học:
(1) C + O2 ->(nhiệt độ) CO2
(2) CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
(3) CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Bài tập 4 SGK Hóa học 9, trang 91
Hãy cho biết trong các cặp chất sau đây, cặp nào có thể tác dụng với nhau.
a) H2SO4 và KHCO3; b) K2CO3 và NaCl; c) MgCO3 và HCl; d) CaCl2 và Na2CO3; e) Ba(OH)2 và K2CO3
Giải thích và viết các phương trình hóa học.
Gợi ý đáp án:
Những cặp chất tác dụng với nhau là cặp chất a, c, d và e. Phương trình hóa học như sau:
H2SO4 + 2KHCO3 → K2SO4 + 2CO2 ↑ + 2H2O
MgCO3 + 2HCl → MgCl2 + CO2 ↑ + H2O
CaCl2 + Na2CO3 → CaCO3 ↓ + 2NaCl
Ba(OH)2 + K2CO3 → BaCO3 ↓ + 2KOH
Cặp chất không tác dụng với nhau: b).
Lưu ý: Điều kiện của phản ứng trao đổi trong dung dịch chỉ xảy ra nếu sản phẩm có chất kết tủa (không tan) hoặc có chất khí tạo thành.
Bài tập 5 SGK Hóa học 9, trang 91
Hãy tính thể tích khí CO2 (đktc) tạo thành để dập tắt đám cháy nếu trong bình chữa cháy có dung dịch chứa 980g H2SO4 tác dụng hết với dung dịch NaHCO3.
Gợi ý đáp án:
Phương trình hóa học của phản ứng:
2NaHCO3 + H2SO4 → Na2SO4 + 2CO2 ↑ + 2H2O
Như vậy: nCO2 = 2 x nH2SO4 = 10 x 2 = 20 mol.
VCO2 = n x 22,4 = 20 x 22,4 = 448 lít.
Trên đây là tổng quan toàn bộ kiến thức lý thuyết về muối cacbonat và gợi ý lời giải một số bài tập trong SGK để bạn đọc ôn tập. Hãy ghé đọc website Monkey thường xuyên để tham khảo thêm nhiều kiến thức môn học thú vị và đừng quên chia sẻ nếu thấy bài viết hữu ích bạn nhé!
Chia sẻ ngaySao chép liên kết
Thông tin trong bài viết được tổng hợp nhằm mục đích tham khảo và có thể thay đổi mà không cần báo trước. Quý khách vui lòng kiểm tra lại qua các kênh chính thức hoặc liên hệ trực tiếp với đơn vị liên quan để nắm bắt tình hình thực tế.
Bài viết liên quan- Khí thiên nhiên là gì? Thành phần, ứng dụng và cách khai thác khí thiên nhiên
- Liên kết ion là gì? Cấu tạo, dấu hiệu nhận biết và bài tập
- Áp suất khí quyển là gì? Công thức, ví dụ và bài tập có đáp án
- Nguyên hàm lượng giác: Khái niệm, công thức, mẹo giải và bài tập chi tiết
- Vì sao phải truyền tải điện năng đi xa?
 Giúp bé giỏi Tiếng Anh Sớm Đăng ký ngay tại đây *Vui lòng kiểm tra lại họ tên *Vui lòng kiểm tra lại SĐT *Vui lòng kiểm tra lại Email Đăng ký ngay Nhận các nội dung mới nhất, hữu ích và miễn phí về kiến thức Giáo dục trong email của bạn *Vui lòng kiểm tra lại Email Đăng Ký Các Bài Viết Mới Nhất
Giúp bé giỏi Tiếng Anh Sớm Đăng ký ngay tại đây *Vui lòng kiểm tra lại họ tên *Vui lòng kiểm tra lại SĐT *Vui lòng kiểm tra lại Email Đăng ký ngay Nhận các nội dung mới nhất, hữu ích và miễn phí về kiến thức Giáo dục trong email của bạn *Vui lòng kiểm tra lại Email Đăng Ký Các Bài Viết Mới Nhất  1 HECTA bằng bao nhiêu MẪU? bao nhiêu MÉT VUÔNG/SÀO?
1 HECTA bằng bao nhiêu MẪU? bao nhiêu MÉT VUÔNG/SÀO?  Toán lớp 5 tỉ số phần trăm: dạng toán, ví dụ và bài tập có lời giải
Toán lớp 5 tỉ số phần trăm: dạng toán, ví dụ và bài tập có lời giải  Danh từ tiếng Việt lớp 4: khái niệm, các loại và bài tập có đáp án
Danh từ tiếng Việt lớp 4: khái niệm, các loại và bài tập có đáp án  60 bài tập sắp xếp lại câu tiếng Anh lớp 4 học kì 1 và 2 (có đáp án)
60 bài tập sắp xếp lại câu tiếng Anh lớp 4 học kì 1 và 2 (có đáp án)  100+ bài tập tiếng Anh lớp 2 có đáp án và PDF tải xuống
100+ bài tập tiếng Anh lớp 2 có đáp án và PDF tải xuống  1 HECTA bằng bao nhiêu MẪU? bao nhiêu MÉT VUÔNG/SÀO?
1 HECTA bằng bao nhiêu MẪU? bao nhiêu MÉT VUÔNG/SÀO?  Toán lớp 5 tỉ số phần trăm: dạng toán, ví dụ và bài tập có lời giải
Toán lớp 5 tỉ số phần trăm: dạng toán, ví dụ và bài tập có lời giải  Danh từ tiếng Việt lớp 4: khái niệm, các loại và bài tập có đáp án
Danh từ tiếng Việt lớp 4: khái niệm, các loại và bài tập có đáp án  60 bài tập sắp xếp lại câu tiếng Anh lớp 4 học kì 1 và 2 (có đáp án)
60 bài tập sắp xếp lại câu tiếng Anh lớp 4 học kì 1 và 2 (có đáp án)  100+ bài tập tiếng Anh lớp 2 có đáp án và PDF tải xuống
100+ bài tập tiếng Anh lớp 2 có đáp án và PDF tải xuống .png)
Đăng ký tư vấn nhận ưu đãi
Monkey Junior
Mới! *Vui lòng kiểm tra lại họ tên *Vui lòng kiểm tra lại SĐT Bạn là phụ huynh hay học sinh ? Học sinh Phụ huynh *Bạn chưa chọn mục nào! Đăng Ký Mua Monkey JuniorTừ khóa » Tính Tan Của Muối Hco3
-
Tôi Yêu Hóa Học - QUY LUẬT BẢNG TÍNH TAN Bazơ - Facebook
-
Muối Cacbonat | Kiến Thức Wiki
-
Bảng Tính Tan Của Axit - Bazơ - Muối đầy đủ Và Mới Nhất Hiện Nay
-
Bảng Tính Tan Hoá Học 11 Đầy Đủ Dễ Nhớ - Kiến Guru
-
Sơ Lược Về Muối Cacbonat Và Hiđrocacbonat NaHCO 3, Ca(HCO3)2 ...
-
Top 15 Gốc Hco3 Có Tan Không 2022
-
Lý Thuyết Axit Cacbonic Và Muối Cacbonat | SGK Hóa Lớp 9
-
Tính Chất Hóa Học Của Axit Cacbonic H2CO3 Muối Cacbonat Và Bài ...
-
Hóa Học - Quy Luật Bảng Tính Tan - Thư Viện Đề Thi
-
Ca(HCO3)2 Có Kết Tủa Không, Ca(HCO3)2 Tan Hay Không Tan?
-
[HÓA] MỘT SỐ PHẢN ỨNG CỦA MUỐI HCO3-, CO3(2-) VÀ HSO4
-
Hóa 11 - MUỐI CACBONAT
-
(DOC) Trac Nghiệm Hóa Học | Nguyễn Vũ Hải Yến
-
Natri Hidrocacbonat - Tính Chất, ứng Dụng Và Cách Sản Xuất