Nhúng 1 Lá Al Vào Dung Dịch CuSO4 . Sau Phản ứng Lấy Al ... - Hoc24
Có thể bạn quan tâm
HOC24
Lớp học Học bài Hỏi bài Giải bài tập Đề thi ĐGNL Tin tức Cuộc thi vui Khen thưởng- Tìm kiếm câu trả lời Tìm kiếm câu trả lời cho câu hỏi của bạn
Lớp học
- Lớp 12
- Lớp 11
- Lớp 10
- Lớp 9
- Lớp 8
- Lớp 7
- Lớp 6
- Lớp 5
- Lớp 4
- Lớp 3
- Lớp 2
- Lớp 1
Môn học
- Toán
- Vật lý
- Hóa học
- Sinh học
- Ngữ văn
- Tiếng anh
- Lịch sử
- Địa lý
- Tin học
- Công nghệ
- Giáo dục công dân
- Tiếng anh thí điểm
- Đạo đức
- Tự nhiên và xã hội
- Khoa học
- Lịch sử và Địa lý
- Tiếng việt
- Khoa học tự nhiên
- Hoạt động trải nghiệm
- Hoạt động trải nghiệm, hướng nghiệp
- Giáo dục kinh tế và pháp luật
Chủ đề / Chương
Bài học
HOC24
 Khách vãng lai Đăng nhập Đăng ký Khám phá Hỏi đáp Đề thi Tin tức Cuộc thi vui Khen thưởng
Khách vãng lai Đăng nhập Đăng ký Khám phá Hỏi đáp Đề thi Tin tức Cuộc thi vui Khen thưởng - Tất cả
- Toán
- Vật lý
- Hóa học
- Sinh học
- Ngữ văn
- Tiếng anh
- Lịch sử
- Địa lý
- Tin học
- Công nghệ
- Giáo dục công dân
- Tiếng anh thí điểm
- Hoạt động trải nghiệm, hướng nghiệp
- Giáo dục kinh tế và pháp luật
Câu hỏi
Hủy Xác nhận phù hợp Chọn lớp Tất cả Lớp 12 Lớp 11 Lớp 10 Lớp 9 Lớp 8 Lớp 7 Lớp 6 Lớp 5 Lớp 4 Lớp 3 Lớp 2 Lớp 1 Môn học Toán Vật lý Hóa học Sinh học Ngữ văn Tiếng anh Lịch sử Địa lý Tin học Công nghệ Giáo dục công dân Tiếng anh thí điểm Đạo đức Tự nhiên và xã hội Khoa học Lịch sử và Địa lý Tiếng việt Khoa học tự nhiên Hoạt động trải nghiệm Hoạt động trải nghiệm, hướng nghiệp Giáo dục kinh tế và pháp luật Mới nhất Mới nhất Chưa trả lời Câu hỏi hay
- Võ Khánh Lê
nhúng 1 lá Al vào dung dịch CuSO4 . Sau phản ứng lấy Al ra thấy khối lượng nhẹ đi 1,38g. Tính khối lượng Al đã phản ứng
Xem chi tiết Lớp 0 Hóa học 2 0
 Gửi Hủy
Gửi Hủy  Dangtheanh 13 tháng 3 2016 lúc 20:40
Dangtheanh 13 tháng 3 2016 lúc 20:40 bie
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy  Nguyễn Thị Minh Nguyệt 25 tháng 2 2017 lúc 15:07
Nguyễn Thị Minh Nguyệt 25 tháng 2 2017 lúc 15:07 2Al + 3CuSO4 \(\rightarrow\) Al2(SO4)3 + 3Cu
m dd giảm= 3 . 64 - 2 . 27 = 138 (g)
Cứ 2 mol Al pư thì khối lượng dd giảm 138 g
Vậy 0,02 mol <---------------------------- 1,38 g
mAl pư= 0,02 . 27 = 0,54 (g)
Đúng 2 Bình luận (1) Gửi Hủy
Gửi Hủy 
- Nguyễn Hoàng Nam
Nhúng một lá nhôm vào dung dịch CuSO 4 . Sau một thời gian, lấy lá nhôm ra khỏi dung dịch thì thấy khối lượng dung dịch giảm 1,38 gám. Khối lượng của Al đã tham gia phản ứng là
A. 0,27 gam ; B. 0,81 gam ; C. 0,54 gam ; D. 1,08 gam.
Xem chi tiết Lớp 9 Hóa học 1 0 Gửi Hủy
Gửi Hủy  Ngô Quang Sinh
Ngô Quang Sinh  30 tháng 4 2019 lúc 14:22
30 tháng 4 2019 lúc 14:22 Đáp án C.
Gọi khối lượng miếng Al là a gam, lượng nhôm đã phản ứng là x gam :
2Al + 3 CuSO 4 → Al 2 SO 4 3 + 3 Cu
Gọi x là khối lượng Al phản ứng.
![]()
So với khối lượng miếng Al ban đầu thì khối lượng miếng Al sau phản ứng tăng 1,38 gam.
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Nguyễn Thị Thúy Hiền
Nhúng 1 lá Al vào dung dịch CuSO4 . Sau phản ứng lấy lá Al ra thấy khối lượng dung dịch nhẹ đi 1,38g. Tính khối lượng Al đã phản ứng
HELP ME!!!![]()
![]()
 Gửi Hủy
Gửi Hủy  Hoàng Tuấn Đăng 24 tháng 2 2017 lúc 20:45
Hoàng Tuấn Đăng 24 tháng 2 2017 lúc 20:45 Lời giải:
PTHH: 2Al + 3CuSO4 ==> Al2(SO4)3 + 3Cu
Đặt số mol Al phản ứng là a (mol)
Theo PTHH, nCu = 1,5a (mol)
=> mCu = 96a (gam)
Ta có: mdung dịch giảm = mCu - mAl = \(96a-27a=1,38\)
Giải phương trình, ta được \(a=0,02\left(mol\right)\)
=> Khối lượng nhôm phản ứng: mAl = \(0,02\cdot27=0,54\left(gam\right)\)
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Nguyễn Minh Tiệp
Hòa tan 11,2g Fe vào 200ml dung dịch CuSO4. Sau một thời gian lấy lá sắt ra, rửa nhẹ, lau khô và đem cân thấy khối lượng kim loại tăng 0,8g. Tính khối lượng Fe đã tham gia phản ứng và khối lượng Cu sinh ra sau phản ứng?
Xem chi tiết Lớp 8 Hóa học 1 0 Gửi Hủy
Gửi Hủy  𝓓𝓾𝔂 𝓐𝓷𝓱
𝓓𝓾𝔂 𝓐𝓷𝓱  11 tháng 6 2023 lúc 21:58
11 tháng 6 2023 lúc 21:58 PTHH: \(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
Đặt \(n_{Fe\left(phản.ứng\right)}=x\left(mol\right)=n_{Cu\left(tạo.ra\right)}\)
\(\Rightarrow64x-56x=0,8\) \(\Rightarrow x=0,1\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe\left(phản.ứng\right)}=0,1\cdot56=5,6\left(g\right)\\m_{Cu\left(tạo.ra\right)}=0,1\cdot64=6,4\left(g\right)\end{matrix}\right.\)
Đúng 1 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Muối Hóa Học
Đề bài: Nhúng thanh nhôm Al vào dung dịch CuSO4, sau một thời gian lấy thanh Al ra cân nặng thấy khối lượng giảm 2,07g.
a) Viết PTHH
b) Tính mAl phản ứng
c) Tính mmuối tạo thành
Cảm ơn nhé !!!
Xem chi tiết Lớp 8 Hóa học 2 1 Gửi Hủy
Gửi Hủy  hnamyuh
hnamyuh  19 tháng 7 2021 lúc 10:15
19 tháng 7 2021 lúc 10:15 a)
$2Al + 3CuSO_4 \to Al_2(SO_4)_3 + 3Cu$
b)
Gọi $n_{Al\ pư} = a(mol)$
Theo PTHH : $n_{Cu} = \dfrac{3}{2}n_{Al\ pư} = 1,5a(mol)$
Ta có :
$64.1,5a - 27a = 2,07 \Rightarrow a = 0,03(mol)$$m_{Al} = 0,03.27 = 0,81(gam)$
c)
$n_{CuSO_4} = n_{Cu} = 1,5a = 0,045(mol)$$m_{CuSO_4} = 0,045.160 = 7,2(gam)$
Đúng 0 Bình luận (1) Gửi Hủy
Gửi Hủy  Thảo Phương
Thảo Phương  19 tháng 7 2021 lúc 10:16
19 tháng 7 2021 lúc 10:16 \(2Al+3CuSO_4\rightarrow Al_2\left(SO_4\right)_3+3Cu\)
Gọi x là số mol Al phản ứng, ta có :
\(m_{KLgiam}=m_{Cu}-m_{Al}=64.\dfrac{3}{2}x-27x=2,07\)
=>x=0,03 (mol)
=> \(m_{Al}=0,03.27=0,81\left(g\right)\)
\(n_{muối}=\dfrac{1}{2}n_{Al}=0,015\left(mol\right)\)
=> \(m_{muối}=0,015.342=5,13\left(g\right)\)
Đúng 2 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Milk___
Cho 333g hh: \(MgSO_4;CuSO_4;BaSO_4\) vào nước thu được dung dịch D và 1 phần không tan C có khối lượng 233g. Nhúng thanh Al vào dung dịch D sau phản ứng nhấc thanh Al ra khỏi dung dịch, làm sạch, sấy khô, thấy khối lượng thanh Al tăng 11,5g
a) Viết pt
b) Tính khối lượng mỗi muối trong hỗn hợp ban đầu
Xem chi tiết Lớp 9 Hóa học 1 0 Gửi Hủy
Gửi Hủy  Như Quỳnh
Như Quỳnh  2 tháng 8 2023 lúc 19:28
2 tháng 8 2023 lúc 19:28 \(MgSO_4;CuSO_4;BaSO_4+H_2O\)
\(\Rightarrow\) Dung dịch D gồm \(MgSO_4;CuSO_4\)
\(\Rightarrow\) Phần không tan là \(BaSO_4\)\(\Leftrightarrow m_{BaSO_4}=233\left(g\right)\)
Vậy \(m_{MgSO_4;CuSO_4}=m_{hh}-m_{BaSO_4}=333-233=100\left(g\right)\)
\(3CuSO_4+2Al\rightarrow Al_2\left(SO_4\right)_3+3Cu\)
TĐB: 1,5x x 1,5x (mol)
Gọi x là số mol của Al
\(m\) khối lượng tăng= \(m_{Cu}-m_{Al}\)
\(\Leftrightarrow11,5=1,5x.64-27x\)
\(\Leftrightarrow11,5=96x-27x\)
\(\Leftrightarrow11,5=69x\)
\(\Leftrightarrow x=\dfrac{1}{6}\left(mol\right)\)
\(m_{CuSO_4}=n.M=1,5x.160=1,5.\dfrac{1}{6}.160=40\left(g\right)\)
\(m_{MgSO_4}=m_{MgSO_4;CuSO_4}-m_{CuSO_4}=100-40=60\left(g\right)\)
Đúng 2 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Khanh Linh
 Gửi Hủy
Gửi Hủy  Minh Nguyệt 24 tháng 12 2020 lúc 16:07
Minh Nguyệt 24 tháng 12 2020 lúc 16:07 \(V_{H_2}\)= \(\dfrac{V}{22,4}=\dfrac{6,72}{22,4}=0,3mol\)PTHH: 2Al+6HCL→2AlCl3+3H2a)Theo pt: \(n_{Al_{ }}=\dfrac{2}{3}n_{H_2}=\dfrac{2}{3}.0,3=0,2mol\)⇒ mAl=n.M=0,2.27=5,4gb)Theo pt:\(n_{HCl}=\dfrac{6}{2}n_{H_2}=\dfrac{6}{2}.0,3=0,9mol\)⇒mHCl=n.M=0,9.36.5=32,85g
Đúng 1 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Nguyễn Duy
Nhúng 1 lá nhôm vào dd 200ml CuSO4 . Sau một thời gian lấy lá nhôm ra khỏi dd làm khô rồi cân thì thấy khối lượng lá nhôm tăng 1,38g
a) Tính khối lượng đồng tạo thành
b) Tính nồng độ mol CuSO4 đã phản ứng
Xem chi tiết Lớp 9 Hóa học 2 0 Gửi Hủy
Gửi Hủy  Nguyễn Hoàng Minh
Nguyễn Hoàng Minh  4 tháng 12 2021 lúc 17:48
4 tháng 12 2021 lúc 17:48 \(a,\) Đặt \(n_{CuSO_4}=x(mol)\)
\(PTHH:2Al+3CuSO_4\to Al_2(SO_4)_3+3Cu\\ \dfrac{2}{3}x.....x......\dfrac{1}{3}x.....x(mol)\\ \Rightarrow \Delta m_{Al\uparrow}=m_{Cu}-m_{Al}=64x-\dfrac{2}{3}.27x=1,38\\ \Rightarrow x=0,03\\ \Rightarrow m_{Cu}=0,03.64=1,92(g)\\ b,n_{CuSO_4}=0,03(mol)\\ \Rightarrow C_{M_{CuSO_4}}=\dfrac{0,03}{0,2}=0,15M\)
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy  Lê Thị Mộng Du 6 tháng 7 2023 lúc 14:47
Lê Thị Mộng Du 6 tháng 7 2023 lúc 14:47 Gọi khối lượng Al ban đầu là a gam khối lượng Al pư là x gamPTHH: 2Al+3CuSO4→Al2(SO4)3+3Cua, vì khối lượng của nhôm sau pư tăng 1,38g, nên ta có PT:(a-x) + 192x/54 = a + 1,38⇒ x= 0,54 ⇒ a= 0,54 + 1,38 = 1,92gb, nAl=0,54/27 = 0,02 mol theo PTHH có nCuSO4=2/3 .nAl = 0,03 mol⇒CMCuSO4=0,03/0,2=0,15MChúc bạn học tốt nha!
Đúng 0 Bình luận (0)
 Gửi Hủy
Gửi Hủy 
- Nguyễn Hoàng Nam
Cho 86 gam hỗn hợp X gồm x mol Fe3O4, (1,05 – 4x) mol FeO, Fe(NO3)2 và Mg tan hết trong 1540 ml dung dịch H2SO4 1M. Sau phản ứng thu được dung dịch Y (chỉ chứa các muối trung hòa) và 0,04 mol N2. Cho KOH dư vào dung dịch Y rồi đun nóng nhẹ thấy số mol KOH phản ứng tối đa là 3,15 mol và có m gam kết tủa xuất hiện. Mặt khác, nhúng thanh Al vào Y sau khi các phản ứng xảy ra hoàn toàn nhấc thanh Al ra cân lại thấy khối lượng tăng 28 gam (kim loại Fe sinh ra bám hết vào thanh Al). Phần trăm khối lượng của Mg trong X gần nhất với?
A. 6,2%
B. 5,2%
C. 4,2%
D. 7,2%
Xem chi tiết Lớp 12 Hóa học 1 0 Gửi Hủy
Gửi Hủy  Ngô Quang Sinh
Ngô Quang Sinh  7 tháng 2 2018 lúc 11:33
7 tháng 2 2018 lúc 11:33 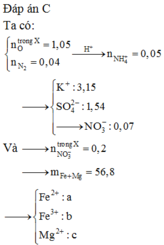
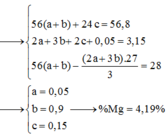
 Gửi Hủy
Gửi Hủy 
- Dieu Anh
nhúng một lá nhôm vào dung dịch CuSO4 . sau một thời gian lấy lá nhôm ra khỏi dd thấy khối lượng nhôm tăng 1,38g a) tính khối lượng nhôm pứ b) khối lượng đồng sunfat tham gia pứ
Xem chi tiết Lớp 9 Hóa học 1 0 Gửi Hủy
Gửi Hủy  Buddy
Buddy  7 tháng 9 2021 lúc 14:00
7 tháng 9 2021 lúc 14:00 Phương trình phản ứng:
2Al + 3CuSO4 --> Al2(SO4)3 + 3Cu
Cứ 2 mol Al thì dung dịch giảm 3.64 - 2.27 = 138 gam
x mol Al thì dung dịch giảm 1,38 gam
Số mol Al tham gia phản ứng là: (1,38 . 2)/138 = 0,02 (gam)
Khối lượng Al là: m = 0,02 . 27 = 0,54 gam
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy Từ khóa » Nhúng Thanh Al Vào Dung Dịch Cuso4
-
Nhúng Một Lá Nhôm Vào Dung Dịch CuSO4. - Hoc247
-
Nhúng 1 Lá Al Vào Dung Dịch CuSO4 . Sau Phản ứng Lấy Lá ... - Hoc24
-
Nhúng Một Thanh Nhôm Kim Loại Vào Dung Dịch CuSO4 Thì Hiện ...
-
Nhúng Một Lá Nhôm Vào Dung Dịch CuSO4. Sau Một Thời Gian, Lấy Lá ...
-
Nhúng Một Thành Al Vào Dung Dịch Chứa 003 Mol CuSO4. Sau Khi ...
-
Nhúng Một Lá Nhôm Vào Dung Dịch CuSO4. Bài 18.6* Trang 23 Sách ...
-
Nhúng Thanh Al Vào Dung Dịch Chứa CuSO4 Và H2SO4, Có Xuất Hiện ...
-
Hiện Tượng Xảy Ra Khi Cho Al Vào ống Nghiệm Chứa Dung Dịch CuSO4
-
Nhúng 1 Thanh Al Sạch Trong Dung Dịch CuSO4 Một Thời Gian Thì Xảy ...
-
Nhúng 1 Thanh Al Vào 300 Ml Dung Dịch CuSO4 1,5M. Sau Khi Phản ...
-
Cho Các Phát Biểu Sau:(a) Nhúng Thanh Al Vào Dung Dịch Chứa ...
-
Nhúng Một Lá Nhôm Vào Dung Dịch CuSO4.... - CungHocVui
-
Tiến Hành Bốn Thí Nghiệm Sau: - Thí Nghiệm 1: Nhúng Thanh