Ôn Tập Hóa Học 8 Chương 1 Chất - Nguyên Tử - Phân Tử
Có thể bạn quan tâm
Đề cương ôn tập Hóa học 9 Chương 1
I. Tóm tắt lý thuyết
1. Chất
- Chất là một dạng của vật chất. Chất tạo nên vật thể.
- Vật thể do nhiều chất tạo nên.
- Mỗi chất có những tính chất vật lí và tính chất hóa học nhất định.
- Chất nguyên chất:
+ là chất không lẫn chất khác.
+ Chất có tính chất nhất định
- Hỗn hợp:
+ Gồm nhiều chất trộn lẫn nhau.
+ Có tính chất thay đổi.
- Dựa vào sự khác nhau về tính chất để tách một chất ra khỏi hỗn hợp bằng phương pháp vật lí thông thường: lọc, đun, chiết, nam châm…
2. Nguyên tử
- Nguyên tử là hạt vô cùng nhỏ và trung hòa về điện. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ tạo bởi một hay nhiều electron mang điện tích âm.
- Hạt nhân tạo bởi proton và nơtron.
- Trong nguyên tử số proton (p,+) bằng số electron (e,-).
Số p = số e
- Electron luôn chuyển động quanh hạt nhân và sắp xếp thành từng lớp.
3. Nguyên tố hóa học
- Nguyên tố hóa học là tập hợp những nguyên tử cùng loại, có cùng số proton trong hạt nhân.
- Kí hiệu hóa học biểu diễn nguyên tố và chỉ một nguyên tử của nguyên tố đó.
- Nguyên tử khối là khối lượng của nguyên tử tính bằng đơn vị cacbon.
- Một đơn vị cacbon bằng 1/12 khối lượng nguyên tử cacbon.
4. Đơn chất và hợp chất - Phân tử
- Đơn chất là những chất tạo nên từ một nguyên tố hóa học.
- Hợp chất là những chất tạo nên từ hai nguyên tố hóa học trở lên.
- Phân tử là hạt đại diện cho chất, gồm một số nguyên tử liên kết với nhau và thể hiện đầy đủ tính chất hóa học của chất.
- Phân tử khối là khối lượng của phân tử tính bằng đơn vị cacbon, bằng tổng nguyên tử khối của các nguyên tử trong phân tử.
- Mỗi mẫu chất là tập hợp vô cùng lớn những hạt nguyên tử hay phân tử. Tùy điều kiện, một chất tồn tại ở 3 trạng thái: rắn, lỏng, khí.
5. Công thức hóa học
- Công thức hóa học dùng để biểu diễn chất.
Dạng chung: Đơn chất Ax ; Hợp chất AxBy
A,B là kí hiệu hóa học
x,y là chỉ số
- Mỗi công thức hóa học chỉ một phân tử của chất, cho biết tên nguyên tố tạo ra chất, số nguyên tử mỗi nguyên tố và phân tử khối.
6. Hóa trị
- Hóa trị là con số biểu thị khả năng liên kết của nguyên tử (hay nhóm nguyên tử) trong phân tử ( H luôn hóa trị I, O luôn hóa trị II).
Quy tắc về hóa trị: x.a = y.b theo AaxBby
+ Biết x,y và a thì tính được b và ngược lại.
+ biết a và b thì tìm được x,y để lập công thức hóa học chuyển thành tỉ lệ: x/y = a/b = a’/b’
II. Bài tập minh họa
Bài 1:
Ghép cột A với cột B sao cho phù hợp
| Cột A | Cột B |
| 1. Nguyên tử khối 2. Phân tử khối 3. Phân tử 4. Kí hiệu hóa học | a.Đại diện cho chất b. Đại diện cho nguyên tố hóa học c. Khối lượng nguyên tử tính bằng đvC d. Khối lượng phân tử tính bằng đvC e. Biểu diễn nguyên tố hóa học, chỉ một nguyên tử của nguyên tố |
Hướng dẫn:
1 -c, 2-d, 3-b, 4 - e
Bài 2:
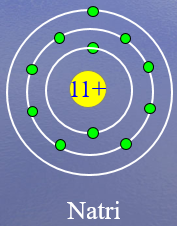
Nhìn vào mô hình cấu tạo của nguyên tử Natri và suy luận các thông tin sau:
1) Số proton?
2) Số electron?
3) Số lớp electron?
4) Số electron lớp ngoài cùng?
Hướng dẫn:
1) Số proton là 11
2) Số electron là 11
3) Số lớp electron là 3
4) Số electron lớp ngoài cùng là 1 electron
Bài 3:
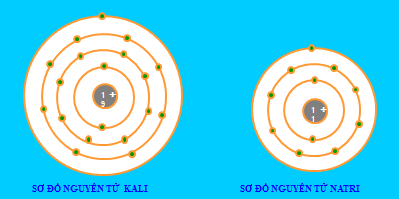
Nêu điểm giống và khác nhau giữa nguyên tử Kali và Natri.
Hướng dẫn:
- Giống nhau: Đều có 1 elctron ở lớp ngoài cùng
- Khác nhau:
- Kali có 19 electron và có 4 lớp electron
- Natri có 11 electron và có 3 lớp electron
Bài 4:
Phân tử một hợp chất gồm 1 nguyên tử nguyên tố X liên kết với 4 nguyên tử hiđro, và nặng bằng nguyên tử oxi.
a, Tính Nguyên tử khối của X, cho biết tên và Kí hiệu hóa học của nguyên tố X.
b, Tính % về khối lượng của nguyên tố X trong hợp chất.
Hướng dẫn:
Ta có: X + 4 = 16 ⇒ x = 12
a. Nguyên tử khối của X là: 12 + 4 = 16
Tên của hợp chât X là Metan
Kí hiệu hóa học của nguyên tố X là C
b. % về khối lượng của nguyên tố Cacbon trong hợp chất metan là:
\(\% C = \frac{{12}}{{12 + 4}}.100 = 75(\%)\)
Bài 5:
Có 6 nguyên tố được đánh số là: (1); (2); (3); (4); (5); (6). Biết rằng:
- Nguyên tử (6) nặng hơn nguyên tử (3) khoảng 1,66 lần.
- Nguyên tử (3) nặng hơn nguyên tử (4) khoảng 1,16 lần.
- Nguyên tử (4) nặng hơn nguyên tử (2) khoảng 1,4 lần.
- Nguyên tử (2) nặng hơn nguyên tử (5) khoảng 2,857 lần.
- Nguyên tử (5) nặng hơn nguyên tử (1) khoảng 1,166 lần
- Biết nguyên tử (1) có nguyên tử khối là 12.
Hãy tìm tên và KHHH của các nguyên tố nói trên. Hướng dẫn:
- Biết nguyên tử (1) có nguyên tử khối là 12. ⇒ (1) là Cacbon, KHHH là C
- Nguyên tử (5) nặng hơn nguyên tử (1) khoảng 1,166 lần nên:
\(\begin{array}{l} \frac{{PTK(5)}}{{PTK(1)}} = 1,166 \Leftrightarrow \frac{{PTK(5)}}{{12}} = 1,166\\ \Rightarrow PTK(5) = 12.1,166 = 14 \end{array}\)
⇒ (5) là nguyên tố Nitơ. KHHH là N
- Nguyên tử (2) nặng hơn nguyên tử (5) khoảng 2,857 lần.
\(\begin{array}{l} \frac{{PTK(2)}}{{PTK(5)}} = 2,857 \Leftrightarrow \frac{{PTK(2)}}{{14}} = 2,857\\ \Rightarrow PTK(2) = 14.2,857 = 40 \end{array}\)
⇒ (2) là nguyên tố Canxi. KHHH là Ca
- Nguyên tử (4) nặng hơn nguyên tử (2) khoảng 1,4 lần.
\(\begin{array}{l} \frac{{PTK(4)}}{{PTK(2)}} = 1,4 \Leftrightarrow \frac{{PTK(4)}}{{40}} = 1,4\\ \Rightarrow PTK(4) = 1,4.40 = 56 \end{array}\)
⇒(4) là nguyên tố Sắt. KHHH là Fe
- Nguyên tử (3) nặng hơn nguyên tử (4) khoảng 1,16 lần.
\(\begin{array}{l} \frac{{PTK(3)}}{{PTK(4)}} = 1,16 \Leftrightarrow \frac{{PTK(3)}}{{56}} = 1,16\\ \Rightarrow PTK(3) = 1,16.56 = 65 \end{array}\)
⇒ (3) là nguyên tố Kẽm. KHHH là Zn
- Nguyên tử (6) nặng hơn nguyên tử (3) khoảng 1,66 lần.
\(\begin{array}{l} \frac{{PTK(6)}}{{PTK(3)}} = 1,66 \Leftrightarrow \frac{{PTK(6)}}{{65}} = 1,66\\ \Rightarrow PTK(6) = 1,66.65 = 108 \end{array}\)
⇒ (6) là nguyên tố Bạc. KHHH là Ag
Vậy 6 nguyên tố đó là: C, N, Ca, Fe, Zn, Ag
Bài 6:
Một hợp chất có phân tử khối là 62. Trong phân tử nguyên tố Oxi chiếm 25,8% theo khối lượng, còn lại là Natri. Hãy cho biết số nguyên tử của mỗi nguyên tố hóa học có trong phân tử của hợp chất,
Hướng dẫn:
Gọi công thức tổng quát của hợp chất trên là NaxOy
Ta có: Trong phân tử nguyên tố Oxi chiếm 25,8% theo khối lượng nên:
\(\begin{array}{l} \% O = \frac{{y.16}}{{62}}.100 = 25,8\\ \Rightarrow y = 1 \end{array}\)
Ta có: phân tử khối là 62 nên
23.x+16.y = 62
⇔ 23.x + 16.1 = 62 ⇒ x = 2
Vậy công thức hóa học của hợp chất X là: Na2O.
Bài 7:
Muối ăn gồm hai nguyên tố hóa học là Na và Cl trong đó Na chiếm 39,3% theo khối lượng. Hãy tìm Công thức hóa học của muối biết Phân tử khối của nó gấp 29,25 lần Phân tử khối của hidro.
Hướng dẫn:
Đặt công thức hóa học chung của hợp chất muối trên là NaxClY
Phân tử khối của nó gấp 29,25 lần Phân tử khối của hidro nên phân tử khối của muối là: 29,25 . 2 = 58,5
Na chiếm 39,3% theo khối lượng nên ta có:
\(\begin{array}{l} \% Na = \frac{{23.x}}{{58,5}}.100 = 39,3\\ \Rightarrow x = 1 \end{array}\)
Ta có phân tử khối của muối bằng 58,5 nên
\(\begin{array}{l} {\rm{ }}23.x + 35,5y = 58,5\\ \Leftrightarrow 23.1 + 35,5 = 58,5\\ \Rightarrow y = 1 \end{array}\)
Vậy công thức hóa học của muối là NaCl
Trắc nghiệm Hóa học 8 Chương 1
- Trắc nghiệm Hóa 8 Bài 2 Chất
- Trắc nghiệm Hóa 8 Bài 4 Nguyên tử
- Trắc nghiệm Hóa 8 Bài 5 Nguyên tố hóa học
- Trắc nghiệm Hóa 8 Bài 6 Đon chất, hợp chất, phân tử
- Trắc nghiệm Hóa 8 Bài 8 Luyện tập
- Trắc nghiệm Hóa 8 Bài 9 Công thức hóa học
- Trắc nghiệm Hóa 8 Bài 10 Hóa trị
- Trắc nghiệm Hóa 8 Bài 11 Luyện tập
Đề kiểm tra Hóa học 8 Chương 1
Trắc nghiệm online Hóa học 8 Chương 1 (Thi Online)
Phần này các em được làm trắc nghiệm online với các câu hỏi trong vòng 45 phút để kiểm tra năng lực và sau đó đối chiếu kết quả từng câu hỏi.
- Đề kiểm tra 1 tiết môn Hóa học 8 Chương 1
- Đề kiểm tra 45 phút Chương 1 Hóa học 8
Đề kiểm tra Hóa học 8 Chương 1 (Tải File)
Phần này các em có thể xem online hoặc tải file đề thi về tham khảo gồm đầy đủ câu hỏi và đáp án làm bài.
- Bộ 4 đề kiểm tra Chương 1 Hóa 9 năm 2018 Trường THCS Lăng Thành (Có đáp án chi tiết)
- Bộ 5 đề kiểm tra 15 phút Chương 1 môn Hóa học 8
- Bộ 4 đề kiểm tra 1 tiết Chương 1 môn Hóa học 8 (có đáp án chi tiết)
- Đề cương ôn tập Chất - Nguyên Tử - Phân tử
Lý thuyết từng bài chương 1 và hướng dẫn giải bài tập SGK
Lý thuyết Hóa học 8 Chương 1
- Lý thuyết Hóa 8 Bài 1 Mở đầu môn Hóa học
- Lý thuyết Hóa 8 Bài 2 Chất
- Lý thuyết Hóa 8 Bài 3 Thực hành
- Lý thuyết Hóa 8 Bài 4 Nguyên tử
- Lý thuyết Hóa 8 Bài 5 Nguyên tố hóa học
- Lý thuyết Hóa 8 Bài 6 Đơn chất, hợp chất - Phân tử
- Lý thuyết Hóa 8 Bài 7 Thực hành
- Lý thuyết Hóa 8 Bài 8 Luyện tập
- Lý thuyết Hóa 8 Bài 9 Công thức hóa học
- Lý thuyết Hóa 8 Bài 10 Hóa trị
- Lý thuyết Hóa 8 Bài 11 Luyện tập
Giải bài tập Hóa học 8 Chương 1
- Giải bài tập SGK Hóa 8 Bài 2 Chất
- Giải bài tập SGK Hóa 8 Bài 3 Thực hành
- Giải bài tập SGK Hóa 8 Bài 4 Nguyên tử
- Giải bài tập SGK Hóa 8 Bài 5 Nguyên tố hóa học
- Giải bài tập SGK Hóa 8 Bài 6 Đơn chất, hợp chất - Phân tử
- Giải bài tập SGK Hóa 8 Bài 8 Luyện tập
- Giải bài tập SGK Hóa 8 Bài 9 Công thức hóa học
- Giải bài tập SGK Hóa 8 Bài 10 Hóa trị
- Giải bài tập SGK Hóa 8 Bài 11 Luyện tập
Trên đây là Ôn tập Hóa 9 Chương 1. Hy vọng với tài liệu này, các em sẽ ôn tập tốt và củng cố kiến thức một cách vững chắc. Để thi online và tải file về máy các em vui lòng đăng nhập vào trang hoc247.net và ấn chọn chức năng "Thi Online" hoặc "Tải về". Ngoài ra, các em còn có thể chia sẻ lên Facebook để giới thiệu bạn bè cùng vào học, tích lũy thêm điểm HP và có cơ hội nhận thêm nhiều phần quà có giá trị từ HỌC247 !
Từ khóa » Câu Hỏi ôn Tập Hóa 8 Chương 1
-
Bài Tập Hóa 8 Chương 1: Chất Nguyên Tử Phân Tử Có đáp án
-
Bài Tập Trắc Nghiệm Hóa Học 8 Chương 1 Có đáp án
-
Bộ đề Kiểm Tra 1 Tiết Chương 1 Môn Hóa Học Lớp 8 (Có đáp án) 9 Đề ...
-
Bài Tập Trắc Nghiệm Hóa Học Lớp 8 Chương I
-
Ôn Tập Chương 1 Môn Hóa Lớp 8
-
Trắc Nghiệm Hoá 8 Chương 1: Chất - Nguyên Tử - Phân Tử (P1)
-
Bài Tập Chương 1 Hóa 8 Cực Hay - 123doc
-
Câu Hỏi Trắc Nghiệm Hóa Học Lớp 8 - Chương 1: Chất - Phân Tử
-
Bộ Câu Hỏi ôn Tập Hóa Học Lớp 8 Có đáp án | Định Nghĩa, Công Thức ...
-
Top 19 đề Cương Hóa 8 Chương 1 Mới Nhất 2022
-
Bộ đề Kiểm Tra 1 Tiết Hóa 8 Chương 1 Có đáp án - Giáo Viên Việt Nam
-
Đề Kiểm Tra 1 Tiết Hóa 8 Chương 1 - Giáo Viên Việt Nam
-
Trắc Nghiệm Hóa Học 8 - Chương 1 - Thư Viện Đề Thi
-
Câu Hỏi Tự Luận Môn Hóa 8