Ozone (O3) Là Gì ?
Có thể bạn quan tâm
Ôzôn|Ozone|Trioxygen là phân tử Phân tử triatomic (Triatomic molecule – các phân tử bao gồm ba nguyên tử) bao gồm 3 nguyên tử Oxy. Ozone là một dạng thù hình (Alltrope – Thù hình là dạng đơn chất khác nhau đó của một nguyên tố) của Oxy nhưng kém ổn đình hơn nhiều so với dạng thù hình Ôxy (O2), phân huỷ với chu kỳ bán rã khoảng nửa giờ trong khí quyển thành Dioxygen (O2) bình thường. Trong tự nhiên Ôzôn được hình thành từ phân tử Oxy do tác động từ tia cực tím UV, phóng điện (Tia sét) trong khí quyển, và có nồng độ thấp trong bầu khí quyển trái đất.Trong ngành công nghiệp sản xuất máy tạo khí ozone, thì Ozone thường tạo ra bằng môi trường có hiệu điện thế cao hoặc đèn UV. Ozone có màu xanh lam nhạt, có mùi hăng đặc biệt, dễ phát hiện được dù chúng tồn tại ở nồng độ nhỏ chỉ 0,1 ppm trong không khí.
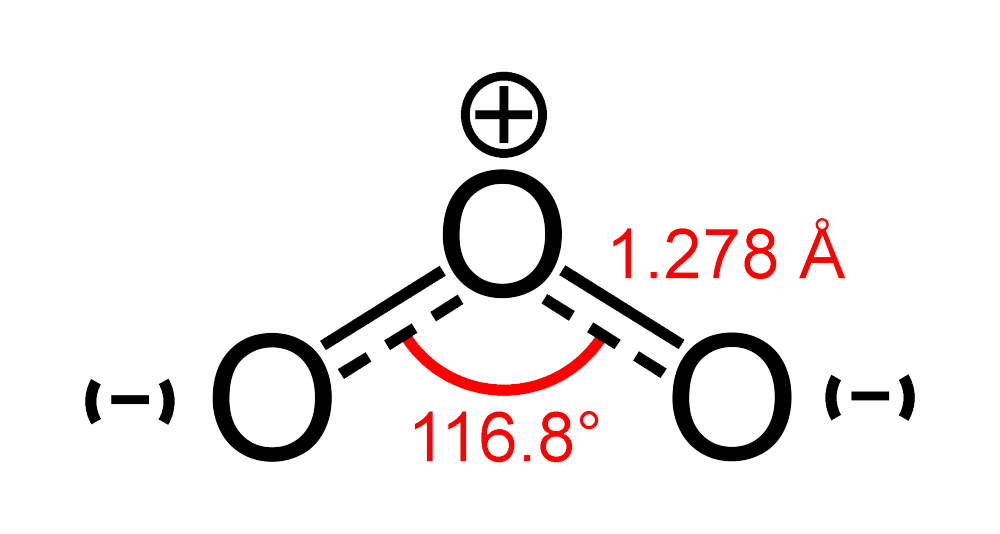
Ozone có đặc tính oxy hoá và là một chất oxy hoá mạnh (Oxidizing agent), được ứng dụng trong công nghiệp, dân dụng. Ở điều kiện tiêu chuẩn, ozon tồn tại ở dạng khí có màu xanh lam nhạt, ngưng tụ ở nhiệt độ lạnh thành chất lỏng màu xanh lam đậm và cuối cùng là chất rắn màu tím đen.
Khí ozone được phát hiện từ khi nào ?
Vào năm 1785, nhà hóa học người Hà Lan, Martin van Marum khi đang tiến hành các thí nghiệm liên quan đến tia lửa điện trên mặt nước thì ông nhận thấy một mùi bất thường, mà ông cho là do phản ứng điện mà không hề nhận biết được đó là do sự xuất hiện của ozone.
Nửa thế kỷ sau, Christian Friedrich Schönbein nhận thấy mùi hăng tương tự và nhận ra đó là mùi thường xuất hiện sau một tia chớp. Năm 1839, ông đã chính thức công nhận chất khí đặc biệt này và đặt tên cho nó là “ozone”, từ tiếng Hy Lạp ozein ( ὄζειν ) có nghĩa là “ngửi”.
Công thức của Ôzôn (O3) không được xác định cho đến năm 1865 bởi Jacques-Louis Soret và được xác nhận bởi Schönbein vào năm 1867.
Tính chất vật lý của khí Ozone

Ozone là một chất khí không màu hoặc màu xanh nhạt, ít tan trong nước và tan nhiều hơn trong các dung môi trơ không phân cực như Carbon tetrachloride hoặc Fluorocarbons. Ở nhiệu đô −112°C hoặc −170 °F, Ozone ngưng tụ để tạo thành chất lỏng màu xanh đậm . Rất nguy hiểm nếu để chất lỏng này đạt đến điểm sôi, vì cả ozone khí đậm đặc và ozone lỏng đều có thể phát nổ. Ở nhiệt độ dưới 193,2 °C; −315,7 ° F, nó tạo thành chất rắn màu đen tím.
Một số phản ứng hoá học của Ozone
Ozone là một trong những chất oxy hoá mạnh nhất được biết đến, mạnh hơn nhiều so với O2 hoặc nhóm chất Halogen. Nó cũng không ổn định ở nồng độ cao, phân hủy thành oxy thông thường. Chu kỳ bán rã của nó thay đổi theo các điều kiện khí quyển như nhiệt độ, độ ẩm và chuyển động của không khí. Trong môi trường văn phòng hoặc gia đình điển hình, nơi sự thay đổi không khí thì ozone có chu kỳ bán rã ngắn khoảng 30 phút.
2 O3→3 O2
Phản ứng này diễn ra nhanh hơn khi nhiệt độ tăng (ứng dụng trong các lò đốt phân rã ozone dư). .
Ozone phản ứng với Kim loại
Ozone sẽ oxy hóa hầu hết các kim loại, trừ vàng, bạch kim, Iridi (một kim loại chuyển tiếp chống ăn mòn, cứng, màu trắng bạc, ký hiệu là Ir) thành oxit của các kim loại ở trạng thái oxy cao nhất của chúng . Ví dụ:
Cu + O3→ CuO + O2
Ag + O3→ AgO + O2
Ozone phản ứng với các hợp chất nitơ
Ozone cũng oxy hóa oxit nitric thành nito dioxit
NO+ O3→ NO2+ O2
Các NO2 có thể bị oxy hóa tiếp tục thành gốc nitrat:
NO2+ O3→ NO3+ O2
Các NO3 tạo thành có thể phản ứng với NO2 để tạo thành N2O5
Phản ứng tạo Nitronium perchlorate (hóa chất vô cơ dạng tinh thể đơn sắc không màu, là một tác nhân oxy hóa và nitrat hóa mạnh) ra từ NO2 , ClO2 và O3:
NO2+ ClO2+ 2 O3→ NO2ClO4+ 2 O2
Ozone không phản ứng với muối amoni nhưng nó oxy hóa amoniac thành amoni nitrat:
2 NH3+ 4 O3→ NH4NO3+ 4 O2+ H2O
Ozone phản ứng Cacbon
Ozone phản ứng với cacbon để tạo thành carbon dioxide, ngay cả ở nhiệt độ phòng:
C + 2 O3→ CO2+ 2 O2
Ozone phản ứng hợp chất lưu huỳnh
Ozone oxy hóa sulfua thành sulfat. Ví dụ, chì (II) sunfua bị oxy hóa thành chì (II) sunfat:
PbS + 4 O 3 → PbSO 4 + 4 O 2
Axit sunfuric có thể được sản xuất từ ozon, nước và lưu huỳnh nguyên tố hoặc lưu huỳnh dioxit:
S + H2O + O3 → H2SO4
3 SO2 + 3 H2O + O3 → 3 H2SO4
Trong pha khí, ozon phản ứng với hydro sunfua để tạo thành lưu huỳnh đioxit:
H2S + O3 → SO2 + H2O
Trong một dung dịch, hai cạnh tranh phản ứng đồng thời xảy ra, chúng được ứng dụng để sản xuất lưu huỳnh nguyên tố, và sản xuất axit sunfuric:
H2S + O3 → S + O2 + H2O
3 H2S + 4 O3 → 3 H2SO4
Phản ứng Đốt cháy
Ozone có thể được sử dụng cho các phản ứng đốt cháy và các khí dễ cháy; ozon cung cấp nhiệt độ cao hơn so với đốt trong dioxygen (O2). Sau đây là một phản ứng để đốt cháy cacbon subnitride cũng có thể gây ra nhiệt độ cao hơn:
3 C4N2+ 4 O3→ 12 CO + 3 N2
Ozone có thể phản ứng ở nhiệt độ đông lạnh. Ở −196,2°C; −321,1° F, hydro nguyên tử phản ứng với ozon lỏng để tạo thành gốc hydro superoxide.
H + O3→ HO2 + O2 HO2 → H2O4
Một số ứng dụng khí Ozone trong thực tế

Ozone có thể được sử dụng để loại bỏ sắt và mangan khỏi nước, tạo thành kết tủa có thể được lọc:
2 Fe2+ + O3 + 5 H2O → 2 Fe(OH)3 + O2 + 4H+
2 Mn2+ + 2 O3 + 4 H2O → 2 MnO(OH)2 + 2 O2 + 4H +
Ozone cũng sẽ oxy hóa hydro sunfua hòa tan trong nước thành axit lưu huỳnh :
3 O3+ H2S → H2SO3 + 3 O2
Ba phản ứng này là trung tâm trong việc sử dụng xử lý nước giếng dựa trên ozone.
Ozone cũng sẽ giải độc xianua bằng cách chuyển đổi chúng để xyanat.
CN – + O3 → CNO-+ O2
Ozone cũng sẽ phân hủy hoàn toàn ure:
(NH2)2CO + O3 → N2 + CO2 + 2 H2O
Video về ứng dụng ozone trong xử lý màu nước
Từ khóa » Khí Ozone Là Gì
-
Tổng Hợp Thông Tin Ozone Và ứng Dụng Trong Y Học | Vinmec
-
Ozone Là Gì? Ứng Dụng Và Những Vấn đề Sức Khỏe Từ Ozone
-
Ozone Là Gì ? Công & Tác Dụng Khử Mùi Của Khí Ozone ?
-
OZONE LÀ GÌ?
-
Ozone Là Gì? Ứng Dụng Của Ozone Trong đời Sống Con Người
-
Ozone Là Gì? Tính Chất Và Tác Dụng Của Khí Ozone - Ozonemaxx
-
Ozone Là Gì? Ozone Tạo Ra Từ đâu? Và ứng Dụng Như Thế Nào
-
Ozone Và ứng Dụng Trong Lĩnh Vực Y Tế
-
Tác Dụng Của Khí Ozon đối Với đời Sống Con Người - Ecomax Ozone
-
Công Nghệ Ozone Và Những Ứng Dụng Trong Đời Sống
-
Xử Lý Nước Bằng Ozone Là Gì Và Nó Hoạt động Như Thế Nào? - NION VN
-
Hít Phải Khí ôzôn Có Hại Không? - Báo Sức Khỏe & Đời Sống
-
Tác Hại Của Khí Ozone Mà Không Phải Ai Cũng Biết ! - Nam Hai Dragon