Phép Chuẩn Phức - THIẾT BỊ KHOA HỌC CÔNG NGHỆ
Có thể bạn quan tâm
Phép chuẩn phức phức tạp (đôi khi chelatometry) là một hình thức phân tích thể tích trong đó việc hình thành một phức hợp màu được sử dụng để chỉ ra điểm kết thúc của phép chuẩn độ. Phép phức phức hợp đặc biệt hữu ích cho việc xác định hỗn hợp các ion kim loại khác nhau trong dung dịch. Một chỉ thị có khả năng tạo ra sự thay đổi màu rõ ràng thường được sử dụng để phát hiện điểm kết thúc của phép chuẩn độ.
 Phản ứng cho phép chuẩn độ Complexometric Về lý thuyết, bất kỳ phản ứng phức tạp nào cũng có thể được sử dụng như một kỹ thuật thể tích miễn là:
Phản ứng cho phép chuẩn độ Complexometric Về lý thuyết, bất kỳ phản ứng phức tạp nào cũng có thể được sử dụng như một kỹ thuật thể tích miễn là:
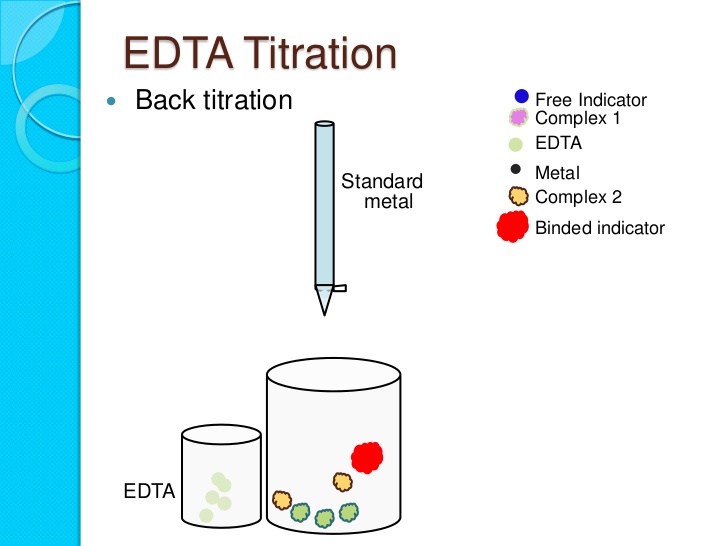
Phản ứng đạt được trạng thái cân bằng nhanh chóng sau mỗi phần của dung dịch bổ sung. Các tình huống can thiệp không phát sinh. Ví dụ, sự hình thành từng bước của một số phức hợp khác nhau của ion kim loại với dung dịch, kết quả là có nhiều hơn một phức trong dung dịch trong quá trình chuẩn độ. Có sẵn một chỉ báo phức tạp có khả năng định vị điểm tương đương với độ chính xác công bằng. Trên thực tế, việc sử dụng EDTA như một chất bổ sung được thiết lập tốt.
Chuẩn độ phức tạp với EDTA EDTA, ethylenediaminetetraacetic acid, có bốn nhóm carboxyl và hai nhóm amin có thể hoạt động như những người cung cấp electron cặp, hoặc các cơ sở của Lewis. Khả năng của EDTA có khả năng hiến 6 cặp electron đơn lẻ cho sự hình thành các liên kết cộng hoá trị với cation kim loại làm cho EDTA một ligand hexadentate. Tuy nhiên, trên thực tế EDTA thường chỉ bị ion hóa một phần, và do đó tạo thành ít hơn sáu liên kết đồng hoá trị với các cation kim loại.
Disodium EDTA thường được sử dụng để chuẩn hóa dung dịch nước của cation kim loại chuyển tiếp. Disodium EDTA (thường được viết bằng Na2H2Y) chỉ tạo thành 4 liên kết cộng hoá trị cation với cation kim loại ở các giá trị pH ≤ 12. Trong khoảng pH này, các nhóm amin vẫn còn proton và do đó không thể hiến điện tử cho sự hình thành các liên kết cộng hóa trị của tọa độ. Lưu ý rằng dạng viết tắt Na4-xHxY có thể được sử dụng để đại diện cho bất kỳ loài nào của EDTA, với x chỉ số lượng proton axit gắn với phân tử EDTA.
EDTA tạo thành một phức hợp bát diện với hầu hết 2 cation kim loại, M2 +, trong dung dịch nước. Lý do chính mà EDTA được sử dụng rộng rãi trong việc chuẩn hóa các dung dịch cation kim loại là hằng số tạo thành đối với hầu hết các phức hợp kim cation-EDTA rất cao, có nghĩa là sự cân bằng của phản ứng:
M2 + + H4Y → MH2Y + 2H + nằm xa bên phải. Thực hiện phản ứng trong một dung dịch đệm cơ bản loại bỏ H + khi nó được hình thành, nó cũng tạo thuận lợi cho sự hình thành của phản ứng phức phức hợp cation EDTA-kim loại. Đối với hầu hết các mục đích, nó có thể được coi là sự hình thành phức hợp kim cation-EDTA sẽ hoàn thành, và đó chính là lý do tại sao EDTA được sử dụng trong chuẩn độ và chuẩn hóa loại này.
Các chỉ số Để thực hiện việc chuẩn độ cation kim loại bằng EDTA, hầu như luôn cần sử dụng một chỉ thị phức tạp để xác định khi nào đạt được điểm kết thúc. Các chỉ số chung là thuốc nhuộm hữu cơ như Sulphon Đen nhanh, Eriochrome đen T, Eriochrome Red B, Patton Reeder, hoặc Murexide. Sự thay đổi màu cho thấy chỉ số đã được di dời (thường là bởi EDTA) từ các cation kim loại trong dung dịch khi đạt đến điểm kết thúc. Do đó, chỉ số tự do (chứ không phải là phức hợp kim loại) đóng vai trò là chỉ thị điểm cuối.
Từ khóa » Công Thức Eriocrom
-
Eriochrome Black T (C.I. 14645) Indicator For Complexometry ACS ...
-
Nghiên Cứu Sự Tạo Phức Của Mg2+ Với Eriocrom đen T(ET 00) Bằng ...
-
BÀI 6 CHUẨN ĐỘ TẠO PHỨC PHƯƠNG PHÁP COMPLEXON
-
Phuong Phap Tao Phuc - SlideShare
-
[PDF] PHẢN ỨNG TẠO PHỨC & CHUẨN ĐỘ
-
[PDF] 1,75.10¹0 - [Ca²+]²
-
[PDF] BẢNG DỮ LIỆU AN TOÀN Eriochrome Cyanine R
-
Xác định độ Cứng Của Nước Bằng Phương Pháp Complexon
-
[PDF] Phiếu An Toàn Hóa Chất - Merck Millipore
-
Đồ án Phương Pháp Chuẩn độ Complexon Và ứng Dụng
-
Chuẩn độ Ngược Là Gì? | Khái Niệm Hoá Học
-
[PDF] II. Thực Hành: Chuẩn độ Tạo Phức Với Complexon - TaiLieu.VN
-
Eriochrome Black T (C.I. 14645) Indicator For ... - LabVIETCHEM