Tính Chất Hóa Học Của Kim Loại Phần 3 - Brom - Iot - Flo - Clo
Có thể bạn quan tâm
Tính Chất Hóa Học Của Kim Loại Phần 3 – Brom – Iot – Flo – Clo
Tiếp tục seri chia sẻ kiến thức về tính chất hóa học của kim loại, hôm nay Hanimex tiếp tục gửi đến các bạn thông tin về tính chất hóa học của brom , iod , flo , clo
Tính chất hóa học của Flo
– Flo là phi kim mạnh nhất (có độ âm điện lớn nhất) nên Flo có tính oxi hóa mạnh nhất.
a) Flo tác dụng với kim loại
– Flo oxi hóa được tất cả các kim loại tạo thành muối florua:
* PTPƯ: 2M + nF2 → 2MFn
* Ví dụ: 2Na + F2 → 2NaF
2Fe + 3F2 → 2FeF3
Zn + F2 → ZnF2
b) Flo tác dụng với phi kim
– Khí flo oxi hóa được hầu hết các phi kim (trừ oxi và nito).
* Ví dụ: 3F2 + S → SF6
c) Flo tác dụng với hiđro H2
– Phản ứng xảy ra ngay cả trong bóng tối (gây nổ mạnh) tạo thành hiđro florua
F2 + H2 → 2HF↑
– Khí HF tan vô hạn trong nước tạo ra dd axit flohidric, khác với axit HCl, axit HF là axit yếu, tính chất đặc biệt của axit HF là tác dụng với silic đioxit (SiO2) có trong thành phần thủy tinh) ⇒ do đó không dùng chai lọ thủy tinh để đựng dd axit HF.
SiO2 + 4HF → SiF4 + 2H2O
d) Flo tác dụng với nước H2O
– Khí flo oxi hóa nước dễ dàng ngay cả ở nhiệt độ thường,Hơi nước bốc cháy khi tiếp xúc với khí flo:
2F2 + 2H2O → 4HF + O2
Tính chất hóa học của Brom
– Brom cũng là nguyên tố oxi hóa mạnh nhưng yếu hơn Flo và Clo.
a) Brom tác dụng với kim loại
– Brom oxi hóa được nhiều kim loại (phản ứng cần đun nóng).
* Ví dụ: 3Br2 + 2Al ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2019_01/giflatexsmallspacexrightarrowt_1548677814.gif) 2AlBr3
2AlBr3
b) Brom tác dụng với hidro H2
– Brom Br2 oxi hóa được hidro H2 ở nhiệt độ cao (không gây nổ) tạo thành hidro bromua.
Br2 + H2 ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2019_01/giflatexsmallspacexrightarrowt_1548677814.gif) 2HBr
2HBr
– Khí HBr tan trong nước tạo thành dd axit bromhidric, đây là axit mạnh, mạnh hơn axit HCl.
c) Brom tác dụng với nước H2O
– Khi tan trong nước, 1 phần brom tác dụng rất chậm với nước tạo ra axit HBr và axit HBrO (axit hipobromơ), là phản ứng thuận nghịch.
Br2 + H2O 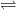 HBr + HBrO
HBr + HBrO

Tính chất hóa học của iot I2
a) iot tác dụng với kim loại
– Iot oxi hóa được nhiều kim loại nhưng chỉ xảy ra khi đun nóng hoặc có xúc tác.
3I2 + 2Al ![small xrightarrow[]{t^{0},xt}](https://hayhochoi.vn/uploads/news/wyswyg/2019_01/giflatexsmallspacexrightarrowt0_1548683292.gif) 2AlI3
2AlI3
b) iot tác dụng với hidro H2
– Phản ứng xảy ra ở nhiệt độ cao, có xúc tác, phản ứng thuận nghịch (tạo thành khí hidro iotua):
I2 + H2 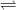 2HI
2HI
– Hidro iotua dễ tan trong nước tạo thành dd axit Iothidric, đó là 1 axit rất mạnh, mạnh hơn cả axit clohidric HCl , bromhidric HBr.
* Iot hầu như KHÔNG tác dụng với H2O
c) Iot có tính oxi hóa kém clo và brom (nên bị clo và brom đẩy ra khỏi muối):
Cl2 + 2NaI → 2NaCl + I2
Br2 + 2NaI → 2NaBr + I2
d) Iot có tính chất đặc trưng là tác dụng với hồ (tinh bột) tạo thành hợp chất có màu xanh.
Tính chất hoá học của Clo (cl)
1. Clo tác dụng với kim loại
– Các halogen hoạt động hoá học mạnh do phân tử của chúng phân li tương đối dễ dàng thành nguyên tử, nguyên tử có tính chất hoá học rất mạnh.
– Phản ứng kết hợp halogen với kim loại xảy ra đặc biệt nhanh và thoát ra nhiệt lượng lớn.
2Na + Cl2 → 2NaCl
– Khi kết hợp với kim loại, các halogen oxi hoá các kim loại đến hoá trị cực đại của kim loại.
3Cl2(khí) + 2Fe(rắn) → 2FeCl3(rắn)
(Nếu Fe dư: Fedư + 2FeCl3 → 3FeCl2)
Cl2(khí) + Cu(rắn) →CuCl2(rắn)
Kết luận: Clo tác dụng với hầu hết các kim loại tạo thành muối clorua.
2. Clo tác dụng với hyđro
Cl2(k) + H2(k) → 2HCl(k)
– Khí HCl tan nhiều trong nước tạo thành dung dịch axit hiđrocloric.
Kết luận: Clo có những tính chất hóa học của phi kim. Clo là một phi kim hoạt động hóa học mạnh, clo không trực tiếp phản ứng với oxi.
3. Clo tác dụng với nước
Cl2(khí)+ H2O (lỏng) ⇌ HCl(dd) + HClO(dd) (phản ứng xảy ra theo 2 chiều ngược nhau).
Chú ý: Nước clo là dung dịch hỗn hợp các chất HCl, HClO và Cl2 nên có màu vàng lục, mùi hắc của khí clo. Nếu cho quỳ tím vào dd đó, lúc đầu quỳ tím hóa đỏ, sau đó nhanh chóng bị mất màu là do tác dụng oxi hóa mạnh của axit hipoclorơ HClO.
4. Clo tác dụng với dung dịch NaOH
Cl2(k) + 2NaOH(dd) → NaCl(dd) + NaClO(dd) + H2O(l)
Chú ý: Dung dịch hỗn hợp gồm NaCl (natri clorua) và NaClO (natri hipoclorit) được gọi là nước Gia-ven. Dung dịch này có tính tẩy màu vì tương tự như HClO, NaClO có tính oxi hóa mạnh.
TAGs : thực hành so sánh vật lý gì methyl bromide cơ bản bài lớp 10 vôi thí nghiệm nêu viết phương trình minh họa k2 cl2o 7 cl2 sống br2 br cl, 5 uraxin mua hủy làm biến đổi cặp nu nào khử power floral lẫn ít tạp thể bỏ 9 số
Từ khóa » Tính Chất Hóa Học Của Flo Brom Iot
-
Tính Chất Hóa Học Của Flo (F) Brom (Br) Iot, Bài Tập Về Flo Brom Iot
-
Tính Chất Vật Lý, Tính Chất Hóa Học Của Flo (F) Brom (Br) Iot (I), Sản ...
-
Tính Chất Hóa Học Của Flo (F), Brom (Br), Iot (I) Dễ Hiểu - Soạn Bài Tập
-
Flo - Brom - Iot - Lý Thuyết, ứng Dụng, điều Chế Và Các Dạng Bài Tập
-
Hoá Học 10 Bài 25: Flo - Brom - Iot
-
Bài 25: Flo - Brom - Iot | SGK Hóa Lớp 10
-
Tính Chất Hóa Học Của Flo (F) Brom (Br) Iot, Bài Tập Về Flo Brom Iot
-
Tính Chất Hóa Học Của Flo (F) Brom (Br) Iot, Bài Tập Về Flo Brom Iot
-
So Sánh Tính Chất Hóa Học Của Flo, Brom Và Iot Với Clo Câu Hỏi 539929
-
Tính Chất Của Flo (F): Tính Chất Hóa Học, Vật Lí, Điều Chế, Ứng Dụng ...
-
Flo – Brom – Iot – Lý Thuyết, ứng Dụng, điều Chế Và Các Dạng Bài Tập
-
Lý Thuyết Bài Flo Brom Iot đầy đủ Nhất - CungHocVui
-
Giáo án Hóa Học 10 Bài 25: Flo – Brom – Iot - Tài Liệu Text - 123doc
-
Giáo án Môn Hóa Học Lớp 10 - Bài 25: Flo – Brom – Iot