Tóm Tắt Lý Thuyết Hóa Học 10 - Chương 1: Nguyên Tử
Có thể bạn quan tâm
Nâng cấp gói Pro để trải nghiệm website VnDoc.com KHÔNG quảng cáo, và tải file cực nhanh không chờ đợi.
Tìm hiểu thêm » Mua ngay Từ 79.000đ Hỗ trợ ZaloTóm tắt lý thuyết Hóa học lớp 10 chương 1
- I. Thành phần cấu tạo của nguyên tử
- II. Kích thước và khối lượng của nguyên tử
- 1. Kích thước
- 2. Khối lượng
- III. Hạt nhân nguyên tử
- 1. Điện tích hạt nhân
- 2. Số khối
- IV. Nguyên tố hóa học
- 1. Định nghĩa
- 2. Số hiệu nguyên tử
- 3. Kí hiệu nguyên tử
- V. Đồng vị
- VI. Nguyên tử khối và nguyên tử khối trung bình của các nguyên tố hóa học
- 1. Nguyên tử khối
- 2. Nguyên tử khối trung bình
- VII. Cấu hình electron nguyên tử
- 1. Sự chuyển động của các electron trong nguyên tử
- 2. Lớp electron và phân lớp electron
- 3. Số electron tối đa trong một phân lớp, một lớp
- 4. Cấu hình electron nguyên tử
- VIII. Câu hỏi bài tập hóa 10 chương 1
- 1. Câu hỏi tự luận
- 2. Câu hỏi trắc nghiệm
Tóm tắt lý thuyết Hóa học 10 - Chương 1: Nguyên tử là tài liệu hỗ trợ kiến thức hóa học lớp 10, giúp các bạn học sinh tổng hợp các kiến thức trọng tâm cần ghi nhớ trong chuyên đề nguyên tử lớp 10, như: thành phần cấu tạo của nguyên tử, kích thước và khối lượng của nguyên tử, hạt nhân nguyên tử...
>> Một số tài liệu liên quan đến chương trình Hóa học 10 MỚI
- Giải Hóa 10 Bài 1 Thành phần của nguyên tử Sách Kết nối tri thức
- Giải Hóa 10 Bài 2: Thành phần của nguyên tử CTST
- Giải Hóa 10 Bài 2: Thành phần của nguyên tử Cánh diều
I. Thành phần cấu tạo của nguyên tử
Kết luận: thành phần cấu tạo của nguyên tử gồm:
- Hạt nhân nằm ở tâm nguyên tử gồm các hạt proton và neutron
- Vỏ nguyên tử gồm các electron chuyển động xung quanh hạt nhân
Electron
- me = 9,1094.10-31 kg
- qe = -1,602.10-19 C qui ước bằng 1-
Proton
- Hạt proton là 1 thành phần cấu tạo của hạt nhân nguyên tử, mang điện tích dương, kí hiệu p
- m = 1,6726.10-27 kg
- q = +1,602.10-19 C qui ước 1+
Nơtron
- Hạt neutron là 1 thành phần cấu tạo của hạt nhân nguyên tử, không mang điện, kí hiệu n. Khối luợng gần bằng khối lượng proton
II. Kích thước và khối lượng của nguyên tử
1. Kích thước
Nguyên tử các nguyên tố có kích thước vô cùng nhỏ, nguyên tố khác nhau có kích thước khác nhau.
Đơn vị biểu diễn A (angstron) hay nm (nanomet)
1nm = 10-9 m; 1nm = 10A
1A = 10-10 m = 10-8 cm
2. Khối lượng
Khối lượng nguyên tử rất nhỏ bé, để biểu thị khối lượng của nguyên tử, phân tử, p, n, e dùng đơn vị khối lượng nguyên tử, kí hiệu u (đvc)
1u = 1/12 khối lượng 1 nguyên tử đồng vị cacbon 12
1u = 19,9265.10-27 kg/12 = 1,6605.10-27 kg
III. Hạt nhân nguyên tử
1. Điện tích hạt nhân
Proton mang điện tích 1+, nếu hạt nhân có Z proton thì điện tích của hạt nhân bằng Z+
Trong nguyên tử:
Số đơn vị điện tích hạt nhân = Số p = Số e
Ví dụ: nguyên tử Na có Z = 11+ → ngtử Na có 11p, 11e
2. Số khối
Là tổng số hạt proton và neutron của hạt nhân đó
A = Z + N
Ví dụ 1: Hạt nhân nguyên tử O có 8p và 8n → A = 8 + 8 = 16
Ví dụ 2: Nguyên tử Li có A = 7 và Z = 3 → Z = p = e = 3; N = 7 - 3 =4
Nguyên tử Li có 3p, 3e và 4n
IV. Nguyên tố hóa học
1. Định nghĩa
Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân
Ví dụ: Tất cả các nguyên tử có cùng Z là 8 đều thuộc nguyên tố oxi, chúng đều có 8p, 8e
2. Số hiệu nguyên tử
Số đơn vị điện tích hạt nhân nguyên tử của 1 nguyên tố được gọi là số hiệu nguyên tử của
nguyên tố đó (Z)
3. Kí hiệu nguyên tử
Số khối
![]() \(_{Z}^{A}X\)
\(_{Z}^{A}X\)
Số hiệu nguyên tửVí dụ : ![]() \(_{11}^{23}Na\)Cho biết nguyên tử của nguyên tố natri có Z=11, 11p, 11e và 12n (23 -11=12)
\(_{11}^{23}Na\)Cho biết nguyên tử của nguyên tố natri có Z=11, 11p, 11e và 12n (23 -11=12)
V. Đồng vị
Các đồng vị của cùng 1 nguyên tố hóa học là những nguyên tử có cùng số proton nhưng khác
nhau về số neutron, do đó số khối của chúng khác nhau
Ví dụ : Nguyên tố oxi có 3 đồng vị
![]() \(_{8}^{16}O , _{8}^{17}O,_{8}^{18}O\)
\(_{8}^{16}O , _{8}^{17}O,_{8}^{18}O\)
Chú ý:
Các nguyên tử của cùng 1 nguyên tố có thể có số khối khác nhau
Các đồng vị có tính chất hóa học giống nhau
VI. Nguyên tử khối và nguyên tử khối trung bình của các nguyên tố hóa học
1. Nguyên tử khối
Nguyên tử khối của 1 nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lầnđơn vị khối lượng nguyên tử
Vì khối lượng nguyên tử tập trung ở nhân nguyên tử nên nguyên tử khối coi như bằng số khối(Khi không cần độ chính xác)
Ví dụ: Xác định nguyên tử khối của P biết P có Z= 15, N=16 => Nguyên tử khối của P = 31
2. Nguyên tử khối trung bình
Trong tự nhiên đa số nguyên tố hóa học là hỗn hợp của nhiều đồng vị (có số khối khác nhau) => Nguyên tử khối của nguyên tố là nguyên tử khối trung bình của các đồng vị đó.
![]()
X, Y: nguyên tử khối của đồng vị X, Y
a, b : % số nguyên tử của đồng vị X, Y
Ví dụ: Clo là hỗn hợp của 2 đồng vị
![]()
chiếm 24,23% nguyên tử khối trung bình của clo là:
![]()
VII. Cấu hình electron nguyên tử
1. Sự chuyển động của các electron trong nguyên tử
Các electron chuyển động rất nhanh trong khu vực xung quanh hạt nhân nguyên tử không theo những quỹ đạo xác định tạo nên vỏ nguyên tử.
Trong nguyên tử: Số e = số p = Z
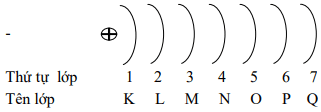
2. Lớp electron và phân lớp electron
a. Lớp electron:
Ở trạng thái cơ bản, các electron lần lƣợt chiếm các mức năng lượng từ thấp đến cao (từ gần hạt nhân ra xa hạt nhân) và xếp thành từng lớp.
Các electron trên cùng một lớp có mức năng lượng gần bằng nhau
b. Phân lớp electron:
Các e trên cùng một phân lớp có mức năng lượng bằng nhau
Các phân lớp được kí hiệu bằng chữ cái thường : s, p, d, f,…
Só phân lớp = số thứ tự của lớp
Ví dụ:
+ Lớp thứ nhất (lớp K, n= 1) có 1 phân lớp:s
+ Lớp thứ hai (lớp L, n= 2) có 2 phân lớp: s, p
+ Lớp thứ ba (lớp M, n= 3) có 3 phân lớp:s, p, d
+ Lớp thứ tự (lớp N, n= 4) có 4 phân lớp: s, p, d, f
Các electron ở phân lớp s gọi là electron s, tương tự ep, ed,…c. Obitan nguyên tử:
Là khu vực không gian xung quanh hạt nhân mà ở đó xác suất có mặt electron là lớn nhất ( 90%) kí hiệu là AO.
Trên 1 AO chỉ chứa tối đa 2 electron được gọi là electron ghép đôi
Nếu trong 1AO chứa 1 lectron được gọi là e độc thân
Nếu trong AO không chứa e được gọi là AO trống.
Phân lớp s có 1 AO hình cầu.
Phân lớp p có 3 AO hình số 8 nổi cân đối.
Phân lớp d có 5 AO hình phức tạp.
Phân lớp f có 7 AO hình phức tạp.
3. Số electron tối đa trong một phân lớp, một lớp
a. Số electron tối đa trong một phân lớp:
| Phânlớp s | Phânlớp p | Phânlớp d | Phânlớp f | |
| Số e tối đa | 2 | 6 | 10 | 14 |
| Cách ghi | s2 | p6 | d10 | f14 |
Phân lớp đã đủ số electron tối đa gọi là phân lớp electron bão hòa.
b. Số electron tối đa trong một lớp:
| LớpThứ tự | Lớp Kn= 1 | Lớp Ln= 2 | Lớp Mn=3 | Lớp Nn= 4 |
| Số phân lớp | 1s | 2s2p | 3s 3p 3d | 4s 4p 4d 4f |
| Số e tối đa (2n2) | 2e | 8e | 18e | 32e |
Lớp electron đã đủ số e tối đa gọi là lớp e bão hòa.
Thí dụ : Xác định số lớp electron của các nguyên tử :
4. Cấu hình electron nguyên tử
a. Nguyên lí vưng bền
Các e trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các mức năng lượng từ thấp đến cao.
Mức năng lượng của : 1s2s2p3s3p4s3d5s4d5p6s4f5d6p7s5f6d...
Khi điện tích hạt nhân tăng lên sẽ xuất hiện sự chèn mức năng lƣợng giữa s và d hay s và f.
Lớp: tăng theo thứ tự từ 1 đến 7 kể từ gần hạt nhân nhất
Phân lớp: tăng theo thứ tự s, p, d, f.
b. Nguyên lí pauli:
Trên 1obitan nguyên tử chứa tối đa 2 electron và có chiều tự quay khác chiều nhau xung quanh trục riêng của mỗi electron.
c. Qui tắc hun:
Trong cùng một phân lớp các electron điền vào các obitan sao cho số lectron độc thân là lớn nhất.
d. Cấu hình electron của nguyên tử:
e. Cấu hình electron của nguyên tử:
Cấu hình electron của nguyên tử biểu diễn sự phân bố electrron trên các phân lớp thuộc các lớp khác nhau.
Quy ước cách viết cấu hình electron:
+ STT lớp e được ghi bằng chữ số (1, 2, 3. . .)
+ Phân lớp đƣợc ghi bằng các chữ cái thƣờng s, p, d, f.
+ Số e được ghi bằng số ở phía trên bên phải của phân lớp.(s2, p6)
Một số chú ý khi viết cấu hình electron:
Cần xác định đúng số e của nguyên tử hay ion. (số e = số p = Z )
Nắm vững các nguyên lí và qui tắc, kí hiệu của lớp và phân lớp ...
Qui tắc bão hoà và bán bão hoà trên d và f: Cấu hình electron bền khi các electron điền vào phân lớp d và f đạt bão hoà (d10, f14 ) hoặc bán bão hoà (d5, f7)
Các bước viết cấu hình electron nguyên tử
Bước 1: Điền lần lƣợt các e vào các phân lớp theo thứ tự tăng dần mức năng lượng.
Bước 2: Sắp xếp lại theo thứ tự các lớp và phân lớp theo nguyên tắc từ trong ra ngoài.
Bước 3: Xem xét phân lớp nào có khả năng đạt đến bão hoà hoặc bán bão hoà, thì có sự sắp xếp lại các electron ở các phân lớp (chủ yếu là d và f)
Ví dụ: Viết cấu hình electron nguyên tử các nguyên tố sau
+ H ( Z = 1)
+ Ne (Z = 10)
+ Cl (Z = 17) 1s22s22p63s23p5
+ Fe, Z = 26, 1s22s22p63s23p63d64s2
+ Cu (Z = 29); Cr (Z = 24)
Cách xác định nguyên tố s, p, d, f:
+ Nguyên tố s: có electron cuối cùng điền vào phân lớp s.
Na, Z = 11, 1s22s22p63s1
+ Nguyên tố p: có electron cuối cùng điền vào phân lớp p.
Br, Z = 35, 1s22s22p63s23p64s23d104p5
Hay 1s22s22p63s23p63d104s24p5
+ Nguyên tố d: có electron cuối cùng điền vào phân lớp d.
Co, Z = 27, 1s22s22p63s23p64s23d7
Hay 1s22s22p63s23p63d74s2
+ Nguyên tố f: có electron cuối cùng điền vào phân lớp f
c. Cấu hình e nguyên tử của 20 nguyên tố đầu (sgk)
d. Đặc điểm của lớp e ngoài cùng:
Đối với nguyên tử của tất cả các nguyên tố, lớp ngoài cùng có nhiều nhất là 8 e.
Các electron ở lớp ngoài cùng quyết định đến tính chất hoá học của một nguyên tố.
+ Những nguyên tử khí hiếm có 8 e ở lớp ngoài cùng (ns2np6) hoặc 2e lớp ngoài cùng (nguyên tử He ns2) không tham gia vào phản ứng hoá học.
+ Những nguyên tử kim loại thường có 1, 2, 3 e lớp ngoài cùng.
Ca, Z = 20, 1s22s22p63s23p64s2, Ca có 2 electron lớp ngoài cùng nên Ca là kim loại.
+ Những nguyên tử phi kim thường có 5, 6, 7 e lớp ngoài cùng.O, Z = 8, 1s22s22p4, O có 6 electron lớp ngoài cùng nên O là phi kim.
+ Những nguyên tử có 4 e lớp ngoài cùng có thể là kim loại hoặc phi kim.
Kết luận: Biết cấu hình electron nguyên tử thì dự đoán tính chất hoá học nguyên
VIII. Câu hỏi bài tập hóa 10 chương 1
1. Câu hỏi tự luận
Bài 1. Viết cấu hình e nguyên tử của các nguyên tố A (Z = 20), B (Z = 36), X (Z = 4) và Y (Z = 16). Xác định vị trí nguyên tố, chu kì, eletron lớp ngoài cùng, số lớp electron. Nguyên tố nào là kim loại, phi kim hay khí hiếm.
Bài 2. Cho biết cấu hình electron ở phân lớp ngoài cùng của các nguyên tử X, Y, Z, T lần lượt là 3p1; 3d5; 4p3; 5s2; 4p64s1.
a. Viết cấu hình electron của mỗi nguyên tử X, Y, Z, T
b. Viết sự phân bố electron trên mỗi lớp.
Bài 3. Xác định cấu tạo hạt (tìm số e, số p, số n), viết kí hiệu nguyên tử của các nguyên tố sau, biết
a. Tổng số hạt cơ bản là 115, số hạt mang điện nhiều hơn số hạt không mang điện là 25 hạt.
b. Tổng số hạt cơ bản là 49, số hạt không mang điện bằng 53,125% số hạt mang điện.
c. Tổng số hạt cơ bản là 52, số hạt không mang điện gấp 1,06 lần số hạt mang điện âm.
Bài 4. Tổng số hạt (p, n, e) trong nguyên tử của một nguyên tố là 34. Xác định nguyên tử khối và viết cấu hình e nguyên tử của nguyên tố biết đó là nguyên tố kim loại?
Bài 5. Mg có 3 đồng vị: 24Mg (78,99%), 25Mg (10%), 26Mg (11,01%).
- Tính nguyên tử khối trung bình của Mg.
- Giả sử một hỗn hợp có 50 nguyên tử 25Mg, thì số nguyên tử tương ứng của 2 đồng vị còn lại là bao nhiêu.
Bài 6. Tổng số hạt (p, n, e) trong phân tử hợp chất MX2 là 96. Trong hạt nhân nguyên tử của M cũng như của X đều có số proton bằng số nơtron. Tổng số proton trong nguyên tử M và X là 26. Tìm hợp chất đã cho.
2. Câu hỏi trắc nghiệm
Câu 1. Số phân lớp e của của lớp M (n = 3) là
A. 4
B. 2
C. 3
D. 1
Câu 2. Nguyên tử được cấu tạo bởi bao nhiêu loại hạt cơ bản?
A. 1
B. 2
C. 3
D. 4
Câu 3. Trong nguyên tử, hạt mang điện là
A. electron
B. electron, nơtron
C. proton, nơtron
D. proton, electron
Câu 4. Số khối của nguyên tử bằng tổng
A. số p và n
B. số p và e
C. số n và e
D. tổng số n, e, p.
Câu 5. Nguyên tử của nguyên tố R có tổng số e, p, n là 137 trong đó có 56 proton. Số notron của R là
A. 56
B. 37
C. 65
D. 81
Câu 6. Số nơtron trong nguyên tử K là
A. 19
B. 20
C. 39
D. 58
Câu 7. Nguyên tử F có 9 proton, 9 electron và 10 notron. Số khối của nguyên tử F là
A. 9
B. 10
C. 19
D. 28
Câu 8. Tổng số hạt p, n, e trong nguyên tử của nguyên tố X bằng 10. Nguyên tố X là
A. Li (Z = 3)
B. Be (Z = 4)
C. N (Z = 7)
D. C (Z = 6)
Để xem và tải đầy đủ chi tiết tài liệu xin vui lòng kéo xuống ấn link TẢI VỀ phía dưới.
Từ khóa » Công Thức Hóa Học Lớp 10 Chương 1
-
Tóm Tắt Công Thức Hóa Học Lớp 10 Chương 1 Hay, Chi Tiết
-
Tóm Tắt Công Thức Hóa Học Lớp 10 Cả Năm Chi Tiết
-
Các Công Thức Hóa Học Lớp 10 Đầy Đủ Nhất - Kiến Guru
-
CÔNG THỨC HÓA 10
-
Ôn Tập Hóa Học 10 Chương 1 Nguyên Tử
-
Tổng Hợp Các Công Thức Hóa Học Lớp 10 đầy đủ, Chi Tiết Nhất
-
Tóm Tắt Lý Thuyết Hóa 10 Chương 1 - Hoá Học Lớp 10 - Haylamdo
-
Các Công Thức Hóa Học Cần Nhớ Lớp 10 - TopLoigiai
-
Các Công Thức Hóa Học Lớp 10 Công Thức Hóa Học Lớp 10
-
Các Công Thức Hóa Học Lớp 10 Đầy Đủ Nhất - MarvelVietnam
-
Tóm Tắt Công Thức Hóa Học Lớp 10 Cả Năm Chi Tiết - Ghế Văn Phòng
-
Tổng Hợp Các Công Thức Hóa Học 10 Cần Nhớ Theo Chương - ToSchool
-
Tổng Hợp Các Dạng Bài Tập Chương 1 Môn Hóa Học Lớp 10