Bảng Tên Gọi Và Gốc Axit - TopLoigiai
Có thể bạn quan tâm
- ÔN TẬP HÓA 11
Axit là phân tử hóa học chúng gồm gốc axit và nguyên tử Hydro. Như vậy, khi tách nguyên tử Hydro ra khỏi phân tử hóa học ta sẽ thu về gốc axit. Trên thực tế gốc axit tồn tại rất nhiều nơi, ngay cả trong thực phẩm hàng ngày như chanh, hoa quả,… Thậm chí là nước mà bạn đang uống hàng ngày khi chưa đi qua hệ thống lọc cũng chứa các gốc axit.
Mục lục nội dung I. Bảng tên gọi ACID (AXIT) theo danh pháp IUPACII. Các gốc axit thường gặp và hướng dẫn đọc tên các gốc axitIII. Cách xác định gốc axit mạnhI. Bảng tên gọi ACID (AXIT) theo danh pháp IUPAC
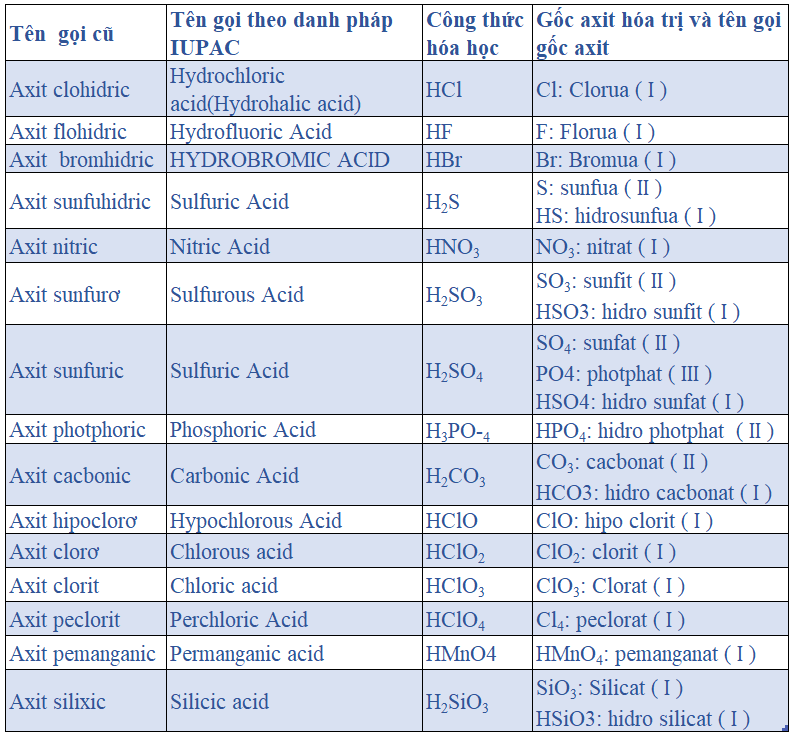
II. Các gốc axit thường gặp và hướng dẫn đọc tên các gốc axit
STT | CTHH | Tên gọi | Kl (đvC) | CTHH | Tên gọi | Hóa trị | Kl (đvC) |
1 | HCl | Axit clohidric | 36.5 | -Cl | Clorua | I | 35.5 |
2 | HBr | Axit bromhidric | 81 | -Br | Bromua | I | 80 |
3 | HF | Axit flohidric | -F | Florua | I | ||
4 | HI | Axit iothidric | 128 | -I | Iotdua | I | 127 |
5 | HNO3 | Axit nitric | -NO3 | Nitrat | I | 62 | |
6 | HNO2 | Axit nitrit | -NO2 | Nitrit | I | 46 | |
7 | H2CO3 | Axit cacbonic | =CO3 | Cacbonat | II | 60 | |
8 | H2SO4 | Axit sufuric | =SO4 | Sunfat | II | 96 | |
9 | H2SO3 | Axit sunfuro | =SO3 | Sunfit | II | 80 | |
10 | H3PO4 | Axit photphoric | PO4 | Photphat | III | 95 | |
11 | H3PO3 | Axit photphoro | PO3 | Photphit | III | 79 | |
12 | =HPO4 | Hidro photphat | II | 96 | |||
13 | -H2PO4 | Di hidro photphat | I | 97 | |||
14 | -HSO4 | Hidro sunphat | I | 97 | |||
15 | -HSO3 | Hidro sunphit | I | 81 | |||
16 | -HCO3 | Hidro cacbonat | I | 61 | |||
17 | H2S | Axit hidro sunfua | =S | Sunfua | II | 32 | |
18 | H2SiO3 | Axit silicric | =SiO3 | Silicat | II | ||
19 | =HPO3 | Hidro photphit | II | ||||
20 | -H2PO3 | Di hidro photphit | I |
III. Cách xác định gốc axit mạnh
a) So sánh định tính tính axit của các axit
- Nguyên tắc chung: Nguyên tử H càng linh động thì tính axit càng mạnh.
- Đối với các axit có oxi của cùng một nguyên tố: càng nhiều O tính axit càng mạnh.
HClO < HClO2 < HClO3 < HClO4
- Đối với axit của các nguyên tố trong cùng chu kì: nguyên tố trung tâm có tính phi kim càng mạnh thì tính axit của axit càng mạnh (các nguyên tố đều ở mức hóa trị cao nhất).
H3PO4 < H2SO4 < HClO4
- Đối với axit của các nguyên tố trong cùng một nhóm A thì:
+ Axit không có oxi: tính axit tăng dần từ trên xuống dưới:
HF < HCl < HBr < HI (do bán kính ion X- tăng)
+ Axit có O: tính axit giảm dần từ trên xuống dưới:
HClO4 > HBrO4 > HIO4 (do độ âm điện của X giảm dần)
- Với các axit hữu cơ RCOOH: (nguyên tử H được coi không có khả năng hút hoặc đẩy e)
+ Nếu gốc R no (đẩy e) làm giảm tính axit. Gốc R no càng nhiều nguyên tử C thì khả năng đẩy e càng mạnh:
HCOOH > CH3COOH > CH3CH2COOH > CH3CH2CH2COOH > n-C4H9COOH.
+ Nếu gốc R hút e (không no, thơm hoặc có halogen...) sẽ làm tăng tính axit.
- Xét với gốc R có chứa nguyên tử halogen:
+ Halogen có độ âm điện càng lớn thì tính axit càng mạnh:
CH2FCOOH > CH2ClCOOH > CH2BrCOOH > CH2ICOOH > CH3COOH
+ Gốc R có chứa càng nhiều nguyên tử halogen thì tính axit càng mạnh:
Cl3CCOOH > Cl2CHCOOH > ClCH2COOH > CH3COOH
+ Nguyên tử halogen càng nằm gần nhóm COOH thì tính axit càng mạnh:
CH3CH2CHClCOOH > CH3CHClCH2COOH > CH2ClCH2CH2COOH > CH3CH2CH2COOH
- Với một cặp axit/bazơ liên hợp: tính axit càng mạnh thì bazơ liên hợp của nó càng yếu và ngược lại.
- Với một phản ứng: axit mạnh đẩy được axit yếu khỏi dung dịch muối (trường hợp trừ một số đặc biệt).
b) So sánh định lượng tính axit của các axit
- Với axit HX trong nước có cân bằng: HX <=> H+ + X– ta có hằng số phân ly axit: KA
- KA chỉ phụ thuộc nhiệt độ, bản chất của axit. Giá trị của KA càng lớn tính axit của axit càng mạnh.
Câu hỏi thường gặp
Đánh giá độ hữu ích của bài viết
😓 Thất vọng🙁 Không hữu ích😐 Bình thường🙂 Hữu ích🤩 Rất hữu ích- Bộ 100 Đề thi Giữa kì, Cuối kì các Môn học mới nhất.
- Tuyển tập các khóa học hay nhất tại Toploigiai.
Xem thêm các bài cùng chuyên mục
- Ankin là gì?
- Công thức cấu tạo hợp chất hữu cơ là gì?
- Chất nào dùng để khắc chữ và hình trên vật liệu thủy tinh?
- Cho Si tác dụng với Mg ở nhiệt độ cao thu được sản phẩm nào sau đây?
- Điều chế silic trong phòng thí nghiệm
- Nitơ tác dụng với oxi
Website khóa học, bài giảng, tài liệu hay nhất
Email: [email protected]
SĐT: 0902 062 026
Địa chỉ: Số 6 ngách 432/18, đường Đội Cấn, Phường Cống Vị, Quận Ba Đình, Thành phố Hà Nội
Hỏi đáp
Về chúng tôi
Giáo viên tại Toploigiai
Báo chí nói về chúng tôi
Giải thưởng
Khóa học
Về chúng tôi
Giáo viên tại Toploigiai
Báo chí nói về chúng tôi
Giải thưởng
Khóa học
CÔNG TY TNHH TOP EDU
Số giấy chứng nhận đăng kí kinh doanh: 0109850622, cấp ngày 09/11/2021, nơi cấp Sở Kế Hoạch và Đầu tư Thành phố Hà Nội
 Đặt câu hỏi
Đặt câu hỏi Từ khóa » Các Gốc Axit Lớp 8
-
VI. Đáp án Hướng Dẫn Giải Chi Tiết
-
Kể Tên Một Số Gốc Axit Thường Gặp - Mai Trang - HOC247
-
Cách đọc Tên Các Chất Hóa Học Lớp 8
-
Axit – Bazơ – Muối – Hóa Học 8 - Null - ICAN
-
Cách Đọc Tên AXIT Và Gốc Axit, Axit Hữu Cơ Hóa Học Lớp 8
-
Kể Tên Một Số Gốc Axit Thường Gặp ( Nhiều Nhiều Chút Nha Mấy Bạn
-
Nêu 1 Số Gốc Axit Thường Gặp (nhiều 1 Chút ạ) - Hoc24
-
Hãy Viết Công Thức Hóa Học Của Các Axit Có Gốc Axit
-
Hãy Viết Công Thức Hóa Học Của Các Axit Có Gốc Axit Cho Dưới đây Và ...
-
Lý Thuyết Hóa Học 8 Bài 37: Axit - Bazơ - Muối Hay, Chi Tiết
-
Bài Tập Xác định Công Thức Hóa Học Và Gọi Tên Axit Cực Hay, Chi Tiết
-
Cách đọc Tên Các Chất Hóa Học Lớp 8 Cách đọc Tên Hóa Học