Điều Chế Axít Sunfuric ( H2SO4 ) Trong Phòng Thí Nghiệm - Svnckh
Có thể bạn quan tâm
Axit sunfuric – H2SO4, là một chất lỏng nhờn, không màu, không mùi, không bay hơi, nặng gần gấp đôi nước (H2SO4 98% ở D = 1,84 g / cm3). Nó là một axit vô cơ mạnh và có thể hòa tan hoàn toàn trong nước theo bất kỳ tỷ lệ nào. Axít sunfuric ( H2SO4 ) có điều chế được trong phòng thí nghiệm hay không, Cách điều chế Axít sunfuric ( H2SO4 ) như thế nào? thì ở bài này chúng ta cùng nhau đi tìm hiểu nhé.
Tìm hiểu về Axit sunfuric – H2SO4
Axit sunfuaric với công thức hóa học : H2SO4
Có thể dễ dàng hòa tan trong nước với bất kỳ tỷ lệ nào , nhưng để pha loãng Axit H2SO4 chúng ta cần phải biết cách pha loãng axit
Axit H2SO4 là một trong những hóa chất được gọi là chủ đạo trong ngành công nghiệp với rất nhiều ứng dụng khác nhau
+ Chất tẩy rửa
+ Phẩm màu
+ Phân bón
+ Xử lý hóa chất
+ Xử lý nước
+ Dệt may …….. và rất nhiều cái khác nữa
Cách điều chế H2SO4 trong phòng thí nghiệm
H2SO4 không được điều chế trong phòng thí nghiệm. Axít sulfuric được tạo thành trong tự nhiên bởi quá trình ôxi hoá quặng pyrit, ví dụ như quặng pirit sắt. Do đó, để có được H2SO4, chúng tôi sẽ tổng hợp một số công thức hóa học tạo thành H2SO4.
Cách điều chế axit H2SO4 trong công nghiệp
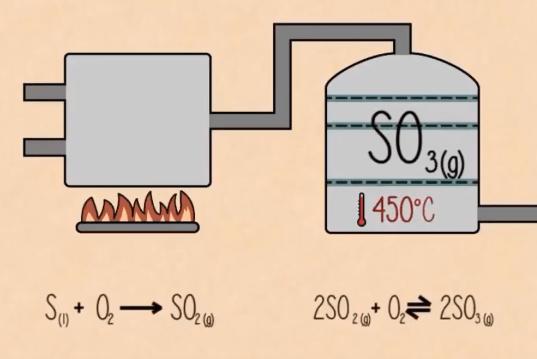
Bước 1:
Trong giai đoạn đầu lưu huỳnh bị đốt để tạo ra điôxít lưu huỳnh. S(r) + O2(k) → SO2(k)
Bước 2: Sau đó nó bị ôxi hóa thành triôxít lưu huỳnh bởi ôxy với sự có mặt của chất xúc tác ôxít vanadi (V). SO2 + O2(k) → 2SO3(k) (với sự có mặt của V2O5)
Nội dung cần tìm hiểu :
- H2SO4 là gì ? Tính chất hóa học và ứng dụng
- BaSO3 ra BaSO4 Viết phương trình phản ứng
- H2SO4 + KOH
Điều chế H2SO4 từ SO2
2KHSO4 ⟶ H2SO4 + K2SO4
nH2O + H2SO4.nSO3 ⟶ n+1H2SO4
2SO2 + (NH3OH)2SO4 ⟶ H2SO4 + 2HSO3NH2 (kt)
2H + 2KCr(SO4)2 ⟶ H2SO4 + K2SO4 + 2CrSO4
2NH4HS + 2CoSO4 ⟶ (NH4)2SO4 + H2SO4 + 2CoS (kt)
BaCl2 + Zn(HSO4)2 ⟶ H2SO4 + ZnCl2 + BaSO4
2KMnO4 + 5H2SO3 ⟶ 3H2O + 2H2SO4 + 2MnSO4 + K2SO4
2H2O + K2S2O8 + MnSO4 ⟶ 2H2SO4 + MnO2 + K2SO4 (kt)
2H2O + K2S2O8 + 2Ce(NO3)3 ⟶ H2SO4 + K2SO4 + 2Ce(NO3)3OH
Pb(HSO4)2 ⟶ H2SO4 + PbSO4(kt)
(dung dịch pha loãng)
6H2S2O7 (oleum) + 2As ⟶ 3H2SO4 + 3SO2(khí) + 2As(HSO4)3
(NH4)2SO4 ⟶ H2SO4 + 2NH3
2HSO3Cl ⟶ H2SO4 + SO2Cl2
H2O2 + SO2 ⟶ H2SO4
H2S + CuSO4 ⟶ CuS + H2SO4
H2 + Ag2SO4 ⟶ 2Ag + H2SO4
H2S2O7 ⟶ H2SO4 + SO3(khí)
HCl + NOHSO4 ⟶ H2SO4 + NOCl
H2O + HSO3F ⟶ H2SO4 + HF
SO3 + 2HSO3Cl ⟶ H2SO4 + S2O5Cl2
HCl + Ag2SO4 ⟶ AgCl + H2SO4
H2O + HSO3Cl ⟶ H2SO4 + HCl
H2O + S + 3HClO ⟶ H2SO4 + 3HCl
HNO3 + H3NSO3 ⟶ H2O + H2SO4 + N2O
2H2O + SO2 + 2At ⟶ H2SO4 + 2HAt
H2O(lạnh) + NOHSO4 ⟶ H2SO4 + HNO2
SO3 + 2NOHSO4 ⟶ H2SO4 + (NO)2S2O7
HNO2 + H3NSO3 ⟶ H2O + H2SO4 + N2
2H2O + I2 + SO2 ⟶ H2SO4 + 2HI
H2O + (C2H5O)2SO2 ⟶ H2SO4 + C2H5OC2H5
Br2 + H2O + H2SO3 ⟶ H2SO4 + 2HBr
4H2O + SF6 ⟶ H2SO4 + 6HF(khí)
4H2O + SClF5 ⟶ H2SO4 + HCl + 5HF
2Na2S2O3 + H2S2O8 ⟶ H2SO4 + Na2SO4 + Na2S4O6
HCl (khí) + H2S2O7 ⟶ H2SO4 + HSO3Cl
2NOHSO4 ⟶ H2SO4 + NO + NO2 + SO3
4Br2 + 4H2O + H2S ⟶ H2SO4 + 8HBr
Cl2 + H2O + H2SO3 ⟶ H2SO4 + 2HCl
H2O + SO2 + (NH3OHCl ⟶ H2SO4 + NH4Cl
HNO3(khan) + HSO3Cl ⟶ H2SO4 + NO2Cl(khí)
Bước 3: Cuối cùng triôxít lưu huỳnh được xử lý bằng nước SO3(k) + H2O(l) → H2SO4(l) + Một phần Oleum ( H2SO7) Sau đó : Oleum sau đó phản ứng với nước để tạo H2SO4 đậm đặc. H2S2O7(l) + H2O(l) → 2 H2SO4(l)
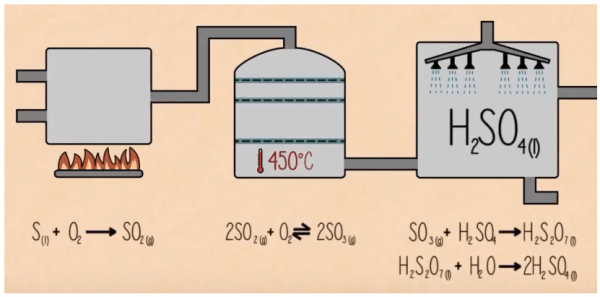
Sau cho được cấp đi sử dụng trong hệ thống công nghiệp, Điều chế axit sunfuaric tùy thuộc vào hệ thống sử dụng, biện pháp sử dụng mà ta pha loãng axit ra bao nhiêu % + 10%, axít sulfuric loãng dùng trong phòng thí nghiệm. + 33,5%, axít cho ắc quy (sử dụng trong các ắc quy axít-chì) + 62,18%, axít trong bể (chì) hay để sản xuất phân bón + 77,67%, axít trong tháp sản xuất hay axít Glover. + 98%, đậm đặc
Một số cách điều chế H2SO4 khác
2KHSO4 ⟶ H2SO4 + K2SO4
nH2O + H2SO4.nSO3 ⟶ n+1H2SO4
2H + 2KCr(SO4)2 ⟶ H2SO4 + K2SO4 + 2CrSO4
2NH4HS + 2CoSO4 ⟶ (NH4)2SO4 + H2SO4 + 2CoS(kt)
BaCl2 + Zn(HSO4)2 ⟶ H2SO4 + ZnCl2 + BaSO4
2KMnO4 + 5H2SO4 ⟶ 3H2O + 2H2SO4 + 2MnSO4 + K2SO4
2H2O + K2S2O8 + MnSO4 ⟶ 2H2SO4 + MnO2(kt) + K2SO4
2H2O + K2S2O8 + 2Ce(NO3)3 ⟶ H2SO4 + K2SO4 + 2Ce(NO3)3OH
Pb(HSO4)2 (dung dịch pha loãng) ⟶ H2SO4 + PbSO4 (kt)
6H2S2O7 (oleum) + 2As ⟶ 3H2SO4 + 3SO2(khí) + 2As(HSO4)3
(NH4)2SO4 ⟶ H2SO4 + 2NH3
2HSO3Cl ⟶ H2SO4 + SO2Cl2
H2O2 + SO2 ⟶ H2SO4
H2S + CuSO4 ⟶ CuS + H2SO4
H2 + Ag2SO4 ⟶ 2Ag + H2SO4
H2S2O7 ⟶ H2SO4 + SO3 (khí)
HCl + NOHSO4 ⟶ H2SO4 + NOCl
H2O + HSO3F ⟶ H2SO4 + HF
SO3 + 2HSO3Cl ⟶ H2SO4 + S2O5Cl2
Từ khóa » điều Chế H2so4 Trong Phòng Thí Nghiệm
-
[CHUẨN NHẤT] Cách điều Chế H2SO4 Trong Phòng Thí Nghiệm
-
Điều Chế Axit Sunfuric H2SO4 Trong Công Nghiệp - Hóa Học THCS
-
Axit Sunfuric (H2SO4) Là Gì? Những ứng Dụng, điều Chế Axit Sunfuric
-
Axit Sulfuric Là Gì? Ứng Dụng Và Nơi Mua Sulfuric Uy Tín Và Chất Lượng
-
NEW Điều Chế H2So4 Trong Công Nghiệp, Điều Chế Axit H2So4 ...
-
Cách điều Chế Axit Sunfuric Trong Công Nghiệp - Giấy Hải Tiến
-
Điều Chế Axit H2SO4 Trong Công Nghiệp
-
Tôi Yêu Hóa Học - TỔNG HỢP PHƯƠNG PHÁP ĐIỀU CHẾ CÁC ...
-
H2S04 Là Gì - Ứng Dụng Axit Sunfuric Trong đời Sống - VIETCHEM
-
Phương Trình điều Chế H2SO4 Từ S
-
Video Mô Phỏng - Điều Chế H2SO4 Trong Công Nghiệp - YouTube
-
Tính Chất Hóa Học Phương Trình Điều Chế Axit Sunfuric - H2SO4
-
Điều Chế H2SO4 Trong Công Nghiệp