Tính Chất Hóa Học Phương Trình Điều Chế Axit Sunfuric - H2SO4
Có thể bạn quan tâm
Tính Chất Hóa Học Phương Trình Điều Chế Axit Sunfuric – H2SO4
Axit Sunfuric là gì ?
Axit sunfuric – H2SO4, là một chất lỏng sánh như dầu, không màu, không mùi, không bay hơi, nặng gần gấp 2 lần nước (H2SO4 98% có D = 1,84 g/cm3). Nó là một axit vô cơ mạnh và khả năng hòa tan hoàn toàn trong nước theo bất kỳ tỷ lệ nào.
Đặc biệt, hoàn toàn không tìm thấy H2SO4 tinh khiết trên Trái Đất, do áp lực rất lớn giữa axít sulfuric và nước. Ngoài ra, axít sulfuric là thành phần của mưa axít, được tạo thành từ điôxít lưu huỳnh trong nước bị ôxi hoá, hay là axít sulfuric bị ôxi hoá.
Công thức phân tử: H2SO4
Công ty hóa chất Hanimex chuyên cung cấp các sản phẩm axit công nghiệp như H2SO4 , HCl , HNO3 , H3PO4 , HF … Chúng tôi có thể đáp ứng mọi yêu cầu về đóng gói từ hàng can , phuy , bồn , tank IBC , xe tec … Quý vị có nhu cầu vui lòng liên hệ đến hotline cuối trang web này để được tư vấn báo giá kịp thời. Xin cảm ơn

Một vài loại Axit Sunfuric cơ bản trên thị trường
Axit sunfuric được sử dụng với những mục đích khác nhau vì vậy sẽ tồn tại ở các dạng khác nhau có thể kể đến như là:
- Axit sunfuric loãng dùng trong phòng thí nghiệm thường chỉ có 10%
- Dùng cho ắc quy khoảng 33,5%
- Hàm lượng 62,18% là axit được dùng để sản xuất phân bón
- 77,67% được dùng trong tháp sản xuất hay axit glover
- 98% là axit đậm đặc
Tính chất đặc trưng của H2SO4
Tính chất vật lý
– Axit sunfuric H2SO4 là chất lỏng, sánh như dầu, nặng gấp 2 lần nước, khó bay hơi và tan vô hạn trong nước.
– Axit sunfuric H2SO4 đặc hút nước mạnh và tỏa nhiều nhiệt nên khi pha loãng phải cho từ từ axit đặc vào nước. Nếu làm ngược lại sẽ làm nước sôi đột ngột bắn ra ngoài kèm theo các giọt axit làm bỏng da hoặc cháy quần áo.
Tính chất hoá học của axit sunfuric H2SO4
1. Axit sunfuric loãng (H2SO4 loãng)
* H2SO4 loãng là một axit mạnh, có đầy đủ các tính chất hóa học chung của axit:
a) Axit sunfuric loãng làm quỳ tím chuyển thành màu đỏ.
b) Axit sunfuric lãng tác dụng với kim loại đứng trước H (trừ Pb) → muối sunfat (trong đó kim loại có hóa trị thấp) + H2↑
– PTPƯ: H2SO4 loãng + Kim loại → Muối + H2↑
Ví dụ: Fe + H2SO4 → FeSO4 + H2↑
Mg + H2SO4 → MgSO4 + H2↑
* Lưu ý:
- nH2 = nH2SO4
- mmuối = mkim loại + mH2SO4 – mH2 = mkim loại + 96nH2
c) Axit sunfuric loãng tác dụng với oxit bazơ → muối (trong đó kim loại giữ nguyên hóa trị) + H2O
– PTPƯ: H2SO4 loãng + Oxit bazo → Muối + H2O
Ví dụ: FeO + H2SO4 → FeSO4 + H2O
MgO + H2SO4 → MgSO4 + H2O
* Lưu ý:
- nH2SO4 = nH2O = nO (trong oxit)
- mmuối = moxit + mH2SO4 – mH2O = moxit + 98nH2SO4 – 18nH2O = moxit + 80nH2SO4 = moxit + 80n(O trong oxit)
d) Axit sunfuric loãng tác dụng với bazơ → muối + H2O
– PTPƯ: H2SO4 loãng + Bazo → Muối + H2O
Ví dụ: H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
– Phản ứng của H2SO4 với Ba(OH)2 hoặc bazơ kết tủa chỉ tạo thành muối sunfat.
Ví dụ: Cu(OH)2 + H2SO4 → CuSO4↓ + 2H2O
Ba(OH)2 + H2SO4 → BaSO4↓ + 2H2O
e) Axit sunfuric loãng tác dụng với muối → muối mới (trong đó kim loại giữ nguyên hóa trị) + axit mới
– PTPƯ: H2SO4 loãng + Muối → Muối mới + Axit mới
Ví dụ: Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
* Lưu ý: Thường dùng phương pháp tăng giảm khối lượng khi giải bài tập về phản ứng của axit sunfuric với muối.
2. Axit sunfuric đặc (H2SO4 đặc)
* Số oxi hóa của mà lưu huỳnh (S) có thể có là: -2 ; 0 ; +4 ; +6. Trong H2SO4 thì S có mức oxi hóa +6 cao nhất nên → H2SO4 đặc có tính axit mạnh, oxi hóa mạnh và có tính háo nước.

a) Axit sunfuric đặc tác dụng với kim loại
– Thí nghiệm: Cho mảnh Cu vào ống nghiệm chứa H2SO4 đặc
– Hiện tượng: dung dịch chuyển sang màu xanh và khí bay ra có mùi sốc.
– Phương trình hóa học:
2H2SO4 + Cu → CuSO4 + SO2↑ + 2H2O
– H2SO4 đặc, nóng tác dụng với các kim loại khác
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
5H2SO4 + 4Zn → 4ZnSO4 + H2S↑ + 4H2O
* Lưu ý:
– Trong các bài tập vận dụng, kim loại tác dụng với axit sunfuric đặc thường gặp nhất là tạo khí SO2, khi giải thường vận dụng bảo toàn e và bảo toàn nguyên tố:
- ne = nkim loại.(hóa trị)kim loại = 2nSO2
- nH2SO4 phản ứng = 2nSO2
- mmuối = mkim loại + 96nSO2
– H2SO4 đặc nguội thụ động (không phản ứng) với Al, Fe và Cr.
– H2SO4 đặc phản ứng được với hầu hết các kim loại (trừ Au và Pt) → muối (trong đó kim loại có hóa trị cao) + H2O + SO2↑ (S, H2S).
– Sản phẩm khử của S+6 tùy thuộc vào độ mạnh của kim loại: kim loại có tính khử càng mạnh thì S+6 bị khử xuống mức oxi hóa càng thấp.
b) Axit sunfuric đặc tác dụng với phi kim → oxit phi kim + H2O + SO2↑
– PTPƯ: H2SO4 đặc + Phi kim → Oxit phi kim + H2O + SO2↑
S + 2H2SO4 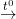 3SO2↑ + 2H2O
3SO2↑ + 2H2O
C + 2H2SO4 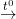 CO2 + 2H2O + 2SO2↑
CO2 + 2H2O + 2SO2↑
2P + 5H2SO4 → 2H3PO4 + 5SO2↑ + 2H2O
c) Axit sunfuric đặc tác dụng với các chất khử khác
– PTPƯ: H2SO4 đặc + chất khử (FeO, FeSO4) → Muối + H2O + SO2↑
2H2SO4 + 2FeSO4 → Fe2(SO4)3 + SO2↑ + 2H2O
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2↑ + 4H2O
d) Tính háo nước của axit sunfuric
– Thí nghiệm: Cho H2SO4 đặc vào cốc đựng đường
– Hiện tượng: Đường chuyển sang màu đen và sôi trào
– Phương trình hóa học:
C12H22O11 + H2SO4 → 12C + H2SO4 .11H2O

Điều chế Axit sulfuric – H2SO4
Axít sulfuric được tạo thành trong tự nhiên bởi quá trình ôxi hoá quặng pyrit, ví dụ như quặng pirit sắt. Phân tử ôxy ôxi hoá quặng pirit sắt (FeS2) thành ion sắt (II) hay Fe2+:
2FeS2 + 7O2 + 2H2O → 2Fe2+ + 4SO42- + 4H+Fe2+ có thể bị ôxi hoá lên Fe3+:
4Fe2+ + O2 + 4H+ → 4 Fe3++ 2H2Ovà Fe3+ tạo ra có thể kết tủa dưới dạng hiđrôxit. Phương trình tạo thành hiđrôxit là
Fe3+ + 3H2O → Fe(OH)3Ion sắt (III) cũng có thể ôxi hóa pirit. Khi sắt (III) xuất hiện, quá trình có thể trở nên nhanh chóng.
Một vài dạng bài tập về Axit Sunfuric
Bài 1 trang 143 sgk hoá 10: Một hợp chất có thành phần theo khối lượng 35,96% S; 62,92 %O và 1,12 %H. Hợp chất này có công thức hóa học là:
A. H2SO3. B. H2SO4. C. H2S2O7. D. H2S2O8.
* Lời giải bài 1 trang 143 sgk hoá 10:
Ta gọi công thức của hợp chất là: HxSyOz
⇒ M = (x + 32y + 16z)
Theo bài ra ta có:
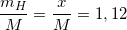 (1)
(1)
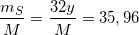 (2)
(2)
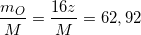 (3)
(3)
Từ (1) và (2) ⇒ x:y = 1:1 = 2:2 (*)
Từ (2) và (3) ⇒ y:z = 2:7 (**)
Vậy từ (*) và (**) ⇒ x:y:z = 2:2:7
⇒ CT: H2S2O7
Kết luận: Đáp án đúng là C
Bài 3 trang 143 SGK Hóa 10: Có 4 lọ, mỗi lọ đựng một dung dịch không màu: NaCl, HCl, Na2SO4, Ba(NO3)2. Hãy nhận biết dung dịch đựng trong mỗi lọ bằng phương pháp hóa học. Viết các phương trình hóa học xảy ra, nếu có.
* Lời giải bài 3 trang 143 SGK Hóa 10:
– Cho dung dịch BaCl2 vào 4 mẫu thử chứa 4 dung dịch trên, dung dịch trong mẫu thửu nào cho kết tủa trắng là Na2SO4
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
– Cho dung dịch AgNO3 vào 3 mẫu thử còn lại, dung dịch trong mẫu không cho kết tủa là Ba(NO3)2, còn 2 mẫu thử còn lại cho kết tủa là HCl và NaCl.
HCl + AgNO3 → AgCl↓ + HNO3
NaCl + AgNO3 → AgCl↓ + NaNO3
– Để phân biệt dung dịch HCl và NaCl, cho quỳ tím vào 2 dung dịch, dung dịch chuyển màu quỳ tím sang đỏ là HCl, dung dịch không làm chuyển màu quỳ tím là NaCl.
Bài 4 trang 143 SGK Hóa 10: a) Axit sunfuric đặc được dùng làm khô những khí ẩm, hãy dẫn ra một thí dụ. Có những khí ẩm không được làm khô bằng axit sunfuric đặc, hãy dẫn ra một thí dụ. Vì sao?
b) Axit sunfric đặc có thể biến nhiều hợp chất hữu cơ thành than được gọi là sự hóa than. Dẫn ra những thí dụ về sự hóa than của glocozơ, saccarozơ.
c) Sự làm khô và sự hóa than khác nhau như thế nào?
* Lời giải Bài 4 trang 143 SGK Hóa 10:
a) Axit sunfuric đặc được dùng làm khô những khí ẩm. Thí dụ làm khô khí CO2, không làm khô được khí H2S, H2, …(do có tính khử).
H2SO4 đặc + H2 → SO2 + 2H2O
H2SO4 đặc + 3H2S → 4S + 4H2O
b) Axit sunfuric đặc có thể biến nhiều hợp chất hữu cơ thành than:
C6H12O6 → 6C + 6H2O
C12H22O11 → 12C + 11H2O
c) Sự làm khô: chất được làm khô không thay đổi.
– Sự hóa than: chất tiếp xúc với H2SO4 đặc biến thành chất khác trong đó có cacbon.
Bài 5 trang 143 sgk hóa 10: a) Trong hợp nào axit sunfuric có nhưng tính chất hóa học chung của một axit ? Đó là những tính chất nào? Dẫn ra những phương trình phản ứng để minh họa.
b) Trong trường hợp nào axit sunfuric có những tính chất hóa học đặc trưng? Đó là những tính chất nào? Dẫn ra những phương trình phản ứng để minh họa.
* Lời giải bài 5 trang 143 sgk hóa 10:
a) Dung dịch axit sunfuric loãng có những tính chất chung của axit, đó là:
– Đổi màu quỳ tím thành đỏ.
– Tác dụng với kim loại giải phóng hiđro.
Fe + H2SO4 → FeSO4 + H2
– Tác dụng với oxit bazơ và bazơ
Ba(OH)2 + H2SO4 → BaSO4↓ + 2H2O
– Tác dụng với nhiều muối
BaCl2 + H2SO4 → BaSO4 +2HCl
b) Tính chất hóa học đặc trưng của axit sunfuric đặc là tính oxi hóa mạnh và tính háo nước.
– Tính chất oxi hóa mạnh
2H2SO4 + Cu → CuSO4 + SO2 + 2H2O
2H2SO4 + S → 3SO2 + 2H2O
2H2SO4 + 2KBr → Br2 + SO2 + 2H2O + K2SO4
– Tính háo nước và tính chất oxi hóa: Axit sunfuric đặc hấp thụ mạnh nước. Axit sunfuric đặc chiếm các nguyên tử H và O là những nguyên tố thành phần của các hợp chất gluxit giải phóng cacbon và nước.
C12H22O11 → 12C + 11H2O.
– Nếu để H2SO4 đặc tiếp xúc với da sẽ bị bỏng rất nặng, vì vậy khi sử dụng axit sunfuric phải hết sức thận trọng.
Bài 6 trang 143 sgk hoá 10: Có 100ml dung dịch H2SO4 98%, khối lượng riêng là 1,84 g/ml. Người ta muốn pha loãng thể tích H2SO4 trên thành dung dịch H2SO4 20%.
a) Tính thể tích nước cần dung để pha loãng.
b) Khi pha loãng phải tiến hành như thế nào?
* Lời giải bài 6 trang 143 sgk hoá 10:
a) Thể tích nước cần dùng để pha loãng.
Theo bài ra, khối lượng của 100ml dung dịch axit 98% là: 100ml × 1,84 g/ml = 184g
Khối lượng H2SO4 nguyên chất trong 100ml dung dịch trên: (184 x 94)/100 = 180,32g
Khối lượng dung dịch axit 20% có chứa 180,32g H2SO4 nguyên chất: (180,32 x 100)/20 = 901,6g
Khối lượng nước cần bổ sung vào 100ml dung dịch H2SO4 98% để có được dung dịch 20%: 901,6g – 184g = 717,6g
Vì D của nước là 1 g/ml nên thể tích nước cần bổ sung là 717,6 ml.
b) Cách tiến hành khi pha loãng:
– Khi pha loãng lấy 717,6 ml H2O vào ống đong hình trụ có thể tích khoảng 2 lít. Sau đó cho từ từ 100ml H2SO4 98% vào lượng nước trên, đổ axit chảy theo một đũa thủy tinh, sau khi đổ vài giọt nên dùng đũa thủy tinh khuấy nhẹ đều. Không được đổ nước vào axit 98%, axit sẽ bắn vào da, mắt,… và gây bỏng da hoặc cháy quần áo.
Trên đây là toàn bộ nội dung bài viết về Axit Sunfuric – H2SO4 mà công ty hóa chất Hanimex đã biên tập được , xin được gửi đến quý bạn đọc tham khảo tìm hiểu.
Quý vị nào có nhu cầu cần được tư vấn , báo giá sản phẩm , đặt mua axit H2SO4 vui lòng liên hệ trực tiếp đến hotline công ty chúng tôi để được hỗ trợ kịp thời .
TAGs : nghiệp sơ đồ liệu gồm mấy đoạn nhờ violet de lam gi nitric ancol bán đâu bốc khói gia bao nhieu nhan biet tốt bazo bt điện li độc cthh chì nitrat cong thuc hoa hoc đồng co mau la nghĩa clo nồng nhiêu dac nguoi kẽm nhôm dau naoh kí hiệu 98 tắt 9 10 h2s04 hidrosunfua ký hồ j sunfurơ lớp nấc dãy thương mại soạn giảng nguy hiểm powerpoint pthh qua giai đời sống td cuộc bari clorua thông cống uống wiki xử tẩy rỉ zn giáo tiết nêu thuốc so đề thi đại kho trắc đáp nâng lop va muoi nơi lẻ hà ảnh toán tiet viên giỏi bai tap chứng sao sinh bình an chuyên natri hại dư sunfua tượng thêm 13g hidroxit chủ yếu bảng cả tắc magie dich bạc fe2o3 nguyen tac loang (106 kno3 nh4cl (nh4)2so4 na3po4 phiếu
Từ khóa » điều Chế H2so4 Trong Phòng Thí Nghiệm
-
[CHUẨN NHẤT] Cách điều Chế H2SO4 Trong Phòng Thí Nghiệm
-
Điều Chế Axít Sunfuric ( H2SO4 ) Trong Phòng Thí Nghiệm - Svnckh
-
Điều Chế Axit Sunfuric H2SO4 Trong Công Nghiệp - Hóa Học THCS
-
Axit Sunfuric (H2SO4) Là Gì? Những ứng Dụng, điều Chế Axit Sunfuric
-
Axit Sulfuric Là Gì? Ứng Dụng Và Nơi Mua Sulfuric Uy Tín Và Chất Lượng
-
NEW Điều Chế H2So4 Trong Công Nghiệp, Điều Chế Axit H2So4 ...
-
Cách điều Chế Axit Sunfuric Trong Công Nghiệp - Giấy Hải Tiến
-
Điều Chế Axit H2SO4 Trong Công Nghiệp
-
Tôi Yêu Hóa Học - TỔNG HỢP PHƯƠNG PHÁP ĐIỀU CHẾ CÁC ...
-
H2S04 Là Gì - Ứng Dụng Axit Sunfuric Trong đời Sống - VIETCHEM
-
Phương Trình điều Chế H2SO4 Từ S
-
Video Mô Phỏng - Điều Chế H2SO4 Trong Công Nghiệp - YouTube
-
Điều Chế H2SO4 Trong Công Nghiệp