Định Luật Bảo Toàn điện Tích - Dạng Bài Tập Thường Gặp Trong đề Thi
Có thể bạn quan tâm
1, Cơ sở và đặc điểm của định luật bảo toàn điện tích
- Là phương pháp giải toán dựa vào quan hệ về số mol
Cụ thể : nion = hệ số . nchất
nđiện tích = điện tích . nion
VD: trong 0,3 mol Fe2(SO4)3 → nFe3+ = 2. 0,3= 0,6 mol → n+= 3.0,6 = 1,8mol
nSO42- = 3.0,3= 0,9 mol → n–= 2.0,9 = 1,8mol
- Trong một phân tử/ 1dd phải có sự trung hòa về điện tích
∑n(+) = ∑n(-)
- Dấu hiệu: đề bài cho số liệu dưới dạng ion ( nion)
KHi các phản ứng trong dd xảy ra hoàn toàn và tạo thành ↓max/ sản phẩm!
Một số ví dụ minh họa
Câu 1: Một dung dịch có chứa các ion:Mg2+ (0,05 mol),K+ (0,15 mol),NO3– (0,1 mol), và SO42- (x mol). Giá trị của x là: A. 0,05. B. 0,075. C. 0,1. D. 0,15.
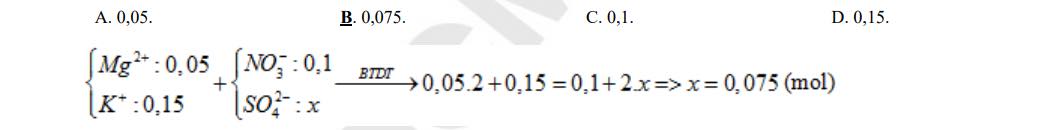
Câu 2: Một dung dịch có chứa 0,02 mol NH4+ , x mol Fe3+ , 0,01 mol Cl– và 0,02 mol SO42- . Khi cô cạn dung dịch này thu được lượng muối khan là:
A. 2,635 gam. B. 3,195 gam. C. 4,315 gam. D. 4,875 gam.
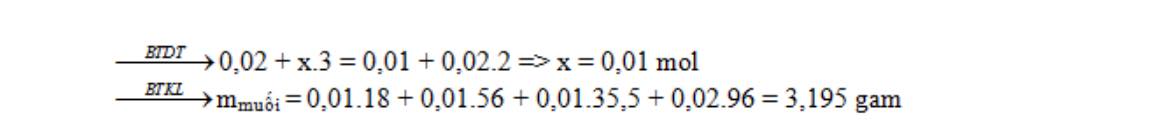
Câu 3: Dung dịch A chứa: 0,15 mol Ca2+ ; 0,6 mol Cl– ; 0,1 mol Mg2+ ; a mol HCO3– ; 0,4 mol Ba2+ . Cô cạn dung dịch A được chất rắn B. Nung B trong không khí đến khối lượng không đổi thu được m gam chất rắn khan. Giá trị của m là:
A. 90,1. B. 105,5. C. 102,2. D. 127,2.
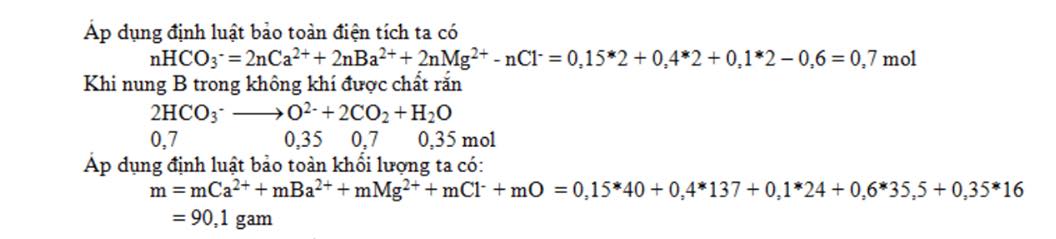
Bài tập tự vận dụng
Bài 1: Dung dịch A chứa 5 ion :Mg2+ ,Ba2+ ,Ca2+ ,Cl– (0,1 mol), NO3– (0,2 mol). Thêm dần V ml dung dịch K2CO3 1M vào dung dịch A cho đến khi lượng kết tủa thu được lớn nhất. Giá trị của V là:
A. 150. B. 300. C. 200. D. 250.
Bài 2: Cho dung dịch X chứa 0,1 mol Al3+ , 0,2 mol Mg2+ , 0,2 mol NO3– , x mol Cl– , y mol Cu2+ . Cho dung dịch X tác dụng với dung dịch AgNO3 dư thì thu được 86,1 gam kết tủa. Nếu cho 850 ml dung dịch NaOH 1M vào dung dịch X thì khối lượng kết tủa thu được là:
A. 26,4 gam. B. 25,3 gam. C. 21,05 gam. D. 20,4 gam.
Bài 3: Cho dung dịch X gồm 0,09 mol Na+ ; 0,05 mol Ca2+ ; 0,08 molCl– ; 0,1 mol HCO3– ; 0,01 mol NO3– . Để loại bỏ hết ion Ca2+ trong X cần dùng 1 lượng vừa đủ dung dịch chứa a gam Ca(OH)2 . Giá trị của a là
A. 2,96 B. 4,44 C. 7,4 D. 3,7
Bài 4: Cho dung dịch X chứa 0,2 mol Al3+ , 0,4 mol Mg2+ , 0,4 mol NO3– , x mol Cl– , y mol Cu2+ – Nếu cho dung dịch X tác dụng với dung dịch AgNO3 dư thì thu được 172,2 gam kết tủa. – Nếu cho 1,7 lit dung dịch NaOH 1M vào dung dịch X thì khối lượng kết tủa thu được là:
A. 25,3 gam B. 20,4 gam C. 40,8 gam D. 48,6 gam
Xem thêm:
Quy tắc đường chéo – Phương pháp trung bình: Các dạng bài tập hay
Phương pháp bảo toàn electron – Dạng bài tập thường gặp trong đề thi
Từ khóa » Các Bài Tập Về định Luật Bảo Toàn điện Tích
-
30 Bài Tập Về Bảo Toàn điện Tích Có Lời Giải (phần 1)
-
Áp Dụng định Luật Bảo Toàn điện Tích Giải Bài Tập Hóa Học Vô Cơ
-
PHƯƠNG PHÁP GIẢI BÀI TẬP BẢO TOÀN ĐIỆN TÍCH - HÓA 11
-
Sử Dụng Phương Pháp Bảo Toàn điện Tích để Giải Bài Tập Sự điện Li ...
-
Bài Tập Trắc Nghiệm: Sử Dụng định Luật Bảo Toàn điện Tích
-
Bài Tập áp Dụng định Luật Bảo Toàn điện Tích Và Cách Giải
-
Giải Bài Tập Hóa Bằng Phương Pháp Bảo Toàn điện Tích
-
Bài Tập Có đáp án Chi Tiết Về định Luật Bảo Toàn điện Tích Môn Hóa ...
-
Bài Tập Thuyết Electron, Định Luật Bảo Toàn điện Tích: Giải Bài 1, 2, 3 ...
-
Dạng 2: Phương Pháp Bảo Toàn điện Tích Và Cách Giải
-
Bài Tập Định Luật Bảo Toàn Điện Tích Vật Lý 11
-
Vận Dụng định Luật Bảo Toàn điện Tích Và Bảo Toàn Năng Lượng Trong ...
-
Bài Tập áp Dụng định Luật Bảo Toàn điện Tích - 123doc
-
Sử Dụng định Luật Bảo Toàn điện Tích - Hoá Học Lớp 11 - Haylamdo