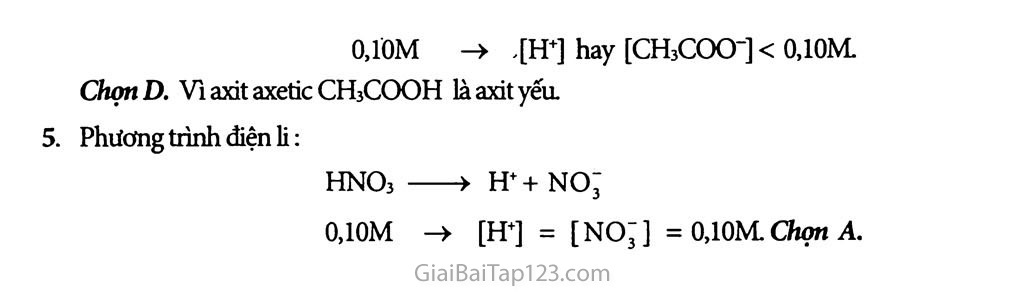
Giải Bài Tập Hóa 11 Bài 2: Axit, Bazơ Và Muối
Có thể bạn quan tâm


- Home
- Lớp 1,2,3
- Lớp 1
- Giải Toán Lớp 1
- Tiếng Việt Lớp 1
- Lớp 2
- Giải Toán Lớp 2
- Tiếng Việt Lớp 2
- Văn Mẫu Lớp 2
- Lớp 3
- Giải Toán Lớp 3
- Tiếng Việt Lớp 3
- Văn Mẫu Lớp 3
- Giải Tiếng Anh Lớp 3
- Lớp 4
- Giải Toán Lớp 4
- Tiếng Việt Lớp 4
- Văn Mẫu Lớp 4
- Giải Tiếng Anh Lớp 4
- Lớp 5
- Giải Toán Lớp 5
- Tiếng Việt Lớp 5
- Văn Mẫu Lớp 5
- Giải Tiếng Anh Lớp 5
- Lớp 6
- Soạn Văn 6
- Giải Toán Lớp 6
- Giải Vật Lý 6
- Giải Sinh Học 6
- Giải Tiếng Anh Lớp 6
- Giải Lịch Sử 6
- Giải Địa Lý Lớp 6
- Giải GDCD Lớp 6
- Lớp 7
- Soạn Văn 7
- Giải Bài Tập Toán Lớp 7
- Giải Vật Lý 7
- Giải Sinh Học 7
- Giải Tiếng Anh Lớp 7
- Giải Lịch Sử 7
- Giải Địa Lý Lớp 7
- Giải GDCD Lớp 7
- Lớp 8
- Soạn Văn 8
- Giải Bài Tập Toán 8
- Giải Vật Lý 8
- Giải Bài Tập Hóa 8
- Giải Sinh Học 8
- Giải Tiếng Anh Lớp 8
- Giải Lịch Sử 8
- Giải Địa Lý Lớp 8
- Lớp 9
- Soạn Văn 9
- Giải Bài Tập Toán 9
- Giải Vật Lý 9
- Giải Bài Tập Hóa 9
- Giải Sinh Học 9
- Giải Tiếng Anh Lớp 9
- Giải Lịch Sử 9
- Giải Địa Lý Lớp 9
- Lớp 10
- Soạn Văn 10
- Giải Bài Tập Toán 10
- Giải Vật Lý 10
- Giải Bài Tập Hóa 10
- Giải Sinh Học 10
- Giải Tiếng Anh Lớp 10
- Giải Lịch Sử 10
- Giải Địa Lý Lớp 10
- Lớp 11
- Soạn Văn 11
- Giải Bài Tập Toán 11
- Giải Vật Lý 11
- Giải Bài Tập Hóa 11
- Giải Sinh Học 11
- Giải Tiếng Anh Lớp 11
- Giải Lịch Sử 11
- Giải Địa Lý Lớp 11
- Lớp 12
- Soạn Văn 12
- Giải Bài Tập Toán 12
- Giải Vật Lý 12
- Giải Bài Tập Hóa 12
- Giải Sinh Học 12
- Giải Tiếng Anh Lớp 12
- Giải Lịch Sử 12
- Giải Địa Lý Lớp 12
Các bài học tiếp theo
- Bài 3: Sự điện ly của nước, pH: Chất chỉ thị aixit bazơ
- Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li
- Bài 5: Luyện tập: Axit, bazơ và muối: Phản ứng trao đổi ion trong dung dịch các chất điện li
- Bài 7: Nitơ
- Bài 8: Amoniac và muối amoni
- Bài 9: Axit nitric và muối nitrat
- Bài 10: Photpho
- Bài 11: Axit photphoric và muối photphat
- Bài 12: Phân bón hóa học
- Bài 13: Luyện tập: Tính chất của nitơ, photpho và các hợp chất của chúng
Các bài học trước
- Bài 1: Sự điện ly
Tham Khảo Thêm
- Giải Bài Tập Hóa Học 11(Đang xem)
- Sách Giáo Khoa - Hóa Học 11
- Giải Hóa 11
Giải Bài Tập Hóa Học 11
- Chương I: SỰ ĐIỆN LY
- Bài 1: Sự điện ly
- Bài 2: Axit, bazơ và muối(Đang xem)
- Bài 3: Sự điện ly của nước, pH: Chất chỉ thị aixit bazơ
- Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li
- Bài 5: Luyện tập: Axit, bazơ và muối: Phản ứng trao đổi ion trong dung dịch các chất điện li
- Chương II: NITTƠ - PHOTPHO
- Bài 7: Nitơ
- Bài 8: Amoniac và muối amoni
- Bài 9: Axit nitric và muối nitrat
- Bài 10: Photpho
- Bài 11: Axit photphoric và muối photphat
- Bài 12: Phân bón hóa học
- Bài 13: Luyện tập: Tính chất của nitơ, photpho và các hợp chất của chúng
- Chương 3: CACBON - SILIC
- Bài 15: Cacbon
- Bài 16: Hợp chất của cacbon
- Bài 17: Silic và hợp chất của silic
- Bài 18: Công nghệ silicat
- Bài 19: Luyện tập: Tính chất của cacbon, silic và các hợp chất của chúng
- Chương 4: ĐẠI DƯƠNG VỀ HÓA HỌC HỮU CƠ
- Bài 20: Mở đầu về hóa hữu cơ
- Bài 21: Công thức phân tử hợp chất hữu cơ
- Bài 22: Cấu trúc phân tử hợp chất hữu cơ
- Bài 23: Phản ứng hữu cơ
- Bài 24: Luyện tập: Hợp chất hữu cơ, công thức phân tử và công thức cấu tạo
- Chương 5: HIĐROCACBON NO
- Bài 25: Ankan
- Bài 26: Xicloankan
- Bài 27: Luyện tập: Ankan và xicloankan
- Chương 6: HIĐROCACBON KHÔNG NO
- Bài 29: Anken (Olefin)
- Bài 30: Ankađien
- Bài 31: Luyện tập: Anken và ankađien
- Bài 32: Ankin
- Bài 33: Luyện tập: Ankin
- Chương 7: HIDROCACBON THƠM, NGUỒN HIĐROCACBON TỰ NHIÊN, HỆ THỐNG HÓA VỀ HIĐROCACBON
- Bài 35: Benzen và đồng đẳng: Một số hiđrocacbon thơm khác
- Bài 36: Luyên tập: Hiđrocacbon thơm
- Bài 37: Nguồn hiđrocacbon thiên nhiên
- Bài 38: Hệ thống hóa về hiđrocacbon
- Chương 8: DẪN XUẤT LAOGEN - ANCOL - PHENOL
- Bài 39: Dẫn xuất halogen của hiđrocacbon
- Bài 40: Ancol
- Bài 41: Phenol
- Bài 42: Luyện tập: Dẫn xuất halogen, ancol và phenol
- Chương 9: ANĐEHIT - XETON - AXIT CACBOXYLIC
- Bài 44: Anđehit - Xeton
- Bài 45: Axit cacboxylic
- Bài 46: Luyện tập: Anđehit - Xeton - Axit cacboxylic
Từ khóa » Chất điện Li Lưỡng Tính
-
Axit Bazơ Muối Và Hidroxit Lưỡng Tính Theo Thuyết Arêniut Và Thuyết ...
-
Sự điện Li Của Axit - Bazo - Muối Và Hidroxit Lưỡng Tính Trong Nước
-
Phương Trình điện Li Zn(OH)2
-
Axit Bazơ Muối Và Hidroxit Lưỡng Tính Theo Thuyết ... - Soạn Bài Tập
-
Hidroxit Lưỡng Tính Là Gì? Hiđroxit Nào Sau đây Có Tính Chất Lưỡng Tính?
-
Hidroxit Lưỡng Tính Là Gì - Bazơ
-
Chất Nào Sau đây Là Hiđroxit Lưỡng Tính? - Luật Hoàng Phi
-
Kiến Thức Hóa Lớp 11 - Sách Giáo Khoa
-
Hidroxit Lưỡng Tính Là Gì - Những Chất Lưỡng Tính Thường
-
Bài 2. Axit, Bazơ Và Muối - Củng Cố Kiến Thức
-
Bài 5. Luyện Tập Axit, Bazơ Và Muối. Phản ứng Trao đổi Ion Trong ...
-
Bài 2: Axit, Bazơ Và Muối - Học Online Cùng
-
Chất Lưỡng Tính, Chất Trung Tính, Hóa Học Phổ Thông
-
Axit - Bazơ - Chất Lưỡng Tính Theo Areniut Và Bronsted; Hằng Số Phân ...