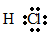Hoá Học 10 Bài 23: Hiđro Clorua - Axit Clohiđric Và Muối Clorua
Có thể bạn quan tâm
Axit clohidric có đầy đủ tính chất của một axit hay không? Nó có những tính chất nào khác so với các axit thông thường? Nhận biết ion Cl- bằng cách nào? Chúng ta cùng nhau tìm hiểu nội dung bài giảng Hiđro clorua - Axit clohiđric và muối clorua để làm rõ các vấn đề nêu trên.
ATNETWORK YOMEDIA1. Tóm tắt lý thuyết
1.1. Hidro clorua - Axit clohidric
1.2. Muối clorua và nhận biết muối clorua
2. Bài tập minh hoạ
3. Luyện tập Bài 23 Hóa học 10
3.1. Trắc nghiệm
3.2. Bài tập SGK và Nâng cao
4. Hỏi đáp về Bài 23 Chương 5 Hóa học 10

Tóm tắt lý thuyết
1.1. Hidro clorua - Axit clohidric
1.1.1. Hydroclorua
Cấu tạo phân tử
- Cặp electron bị lệch về phía clo vì clo có độ âm điện lớn hơn hydro.
- Công thức electron:
Tính chất
- Hyđroclorua là chất khí, không màu, tan nhiều trong nước (1lít nước hòa tan 500 lít HCl)
- Hyđroclorua nặng hơn không khí
- Khí HCl không làm quì tim (khô) hóa đỏ
- Khí HCl không tác dụng với CaCO3,...
Video 1: Khí HCl tan trong nước
- Lí giải vì sao nước lại phun vào bình là do khí Hidroclorua tan nhiều trong nước tạo ra sự giảm mạnh áp suất trong bình, áp suất của khí quyển đẩy nước vào thế chỗ khí HCl đã hòa tan.
- Dung dịch thu được là axit nên làm dung dịch quỳ tím ngả sang màu đỏ. Vậy, khí HCl tan rất nhiều trong nước. Người ta xác định được ở 200C, một thể tích nước có thể hòa tan tới gần 500 thể tích khí HCl.
1.1.2. Axit clohiđric
Tính chất vật lí
- Axit clohiđric là chất lỏng không màu, mùi xốc.
- HCl đặc C% ≈ 37% và D = 1,19(g/ml)
- HCl đặc bốc khối trong không khí ẩm.
Tính chất hóa học
- Axit clohiđric là axit mạnh có đầy đủ tính chất của một axit: là làm đổi màu quỳ, tác dụng với kim loại đứng trước Hidro, tác dụng với bazơ, oxit bazơ tạo muối + nước và tác dụng được với muối.
Ví dụ:
2HCl + Fe → FeCl2 + H2
2HCl + CuO → CuCl2 + H2O
2HCl + Fe(OH)2 → FeCl2 + H2O
2HCl + Na2CO3 → 2NaCl + CO2 + H2O
HCl + AgNO3 → HNO3 + AgCl
- Axit clohiđric có tính khử:
Do trong phân tử HCl, nguyên tố clo có số oxi hóa thấp nhất (-1). Khi dung dịch HCl đặc tác dụng với chất oxi hóa mạnh như MnO2, KMnO4 ... thì HCl bị oxi hóa thành Cl2.
Ví dụ:
\(\mathop {Pb}\limits^{ + 4} {O_2} + {\rm{ }}4H\mathop {Cl}\limits^{ - 1} \to \mathop {Pb}\limits^{ + 2} C{l_2} + {\rm{ }}\mathop {C{l_2}}\limits^0 + {\rm{ }}2{H_2}O\)
\(\mathop {Mn}\limits^{ + 4} {O_2} + H\mathop {Cl}\limits^{ - 1} \to \mathop {Mn}\limits^{ + 2} C{l_2} + \mathop {C{l_2}}\limits^0 + 2{H_2}O\)
1.1.3. Điều chế
- Trong phòng thí nghiệm
NaCl + H2SO4 
NaCl + H2SO4 
Video 2: Điều chế HCl
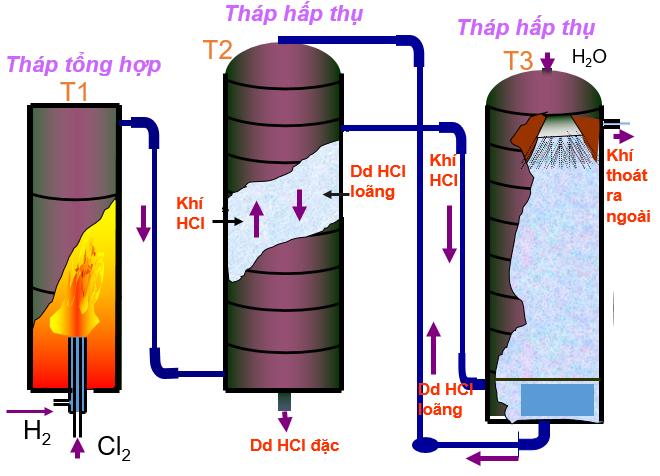
- Trong công nghiệp
- Trong công nghiêp (phương pháp tổng hợp) đốt Cl2 và H2 lấy từ phương trình điện phân dung dịch NaCl
H2 + Cl2 → 2HCl
NaCl + H2SO4 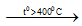
Hình 1: Sơ đồ thiết bị sản xuất HCl trong công nghiệp
- Clo hóa các hợp chất hữu cơ đặc biệt là hyđrocacbon.
C2H6 + Cl2 → C2H5Cl + HCl
1.2. Muối clorua và nhận biết muối clorua
1.2.1. Một số muối clorua
- Ví dụ:
NaCl: làm muối ăn
ZnCl2: dùng làm chất chống mục;
BaCl2: thuốc trừ sâu;
KCl: phân bón;
- Đa số các muối clorua tan nhiều trong nước, trừ AgCl không tan, ít tan:CuCl, PbCl2
- Ứng dụng quan trọng nhất là muối NaCl. Ngoài việc làm muối ăn và bảo quản thực phẩm, NaCl còn là nguyên liệu quan trọng đối với ngành công nghiệp hóa chất để điều chế Cl2, H2, NaOH, nước Javen...
1.2.2. Nhận biết ion clorua
- Thuốc thử: dd AgNO3
- Phương pháp: cho vài giọt dd AgNO3 vào dung dịch cần phân biệt nếu có thấy xuất hiện kết tủa không tan trong axit mạnh → HCl hoặc muối clorua.
AgNO3 + HCl → AgCl ↓+ HNO3
AgNO3 + NaCl → AgCl ↓ + NaNO3
Video 3: Nhận biết ion Clorua (Cl-)
Bài tập minh họa
Bài 1:
Ngâm một lá kim loại X có khối lượng 32 gam trong dung dịch HCl, sau khi thu được 2,24 lít khí (đktc) khối lượng lá kim loại đã giảm đi 7,5% so với ban đầu. X là kim loại nào trong các kim loại sau đây?
Hướng dẫn:
Phương trình hóa học:
X + n HCl → XCln + n/2 H2
0,2/n ← 0,1
=> m X pư = 75% m X bđ = 75%. 32 = 2,4 gam
=> M X = 2,4n : 0,2 = 12n
X là Magie
Bài 2:
Cho m gam hỗn hợp kim loại Zn, Cu vào dung dịch HCl (dư). Sau khi các phản ứng xảy ra hoàn toàn, thu được 4,48 lít H2 (đktc) và 2,0 gam kim loại không tan. Giá trị của m là:
Hướng dẫn:
Cu không phản ứng với dung dịch HCl. 2 gam chất rắn không tan chính là khối lượng của Cu.
Số mol khí H2 thoát ra là do phản ứng của Zn với HCl. Nhận thấy số e trao đổi bằng nhau nên
\({n_{Zn}} = {n_{{H_2}}} = \frac{{4,48}}{{22,4}} = 0,2 \Rightarrow {m_{Zn}} = 0,2.65 = 13(gam)\)
Gía trị m = 2 + 13 = 15 ( gam)
Bài 3:
Cho 18,6 gam hỗn hợp Fe và Zn vào 500 ml dung dịch HCl x mol/l. Sau phản ứng hoàn toàn cô cạn được 34,575 gam chất rắn. Nếu cho hỗn hợp trên tác dụng với 800 ml dung dịch HCl x mol/l cô cạn thu được 39,9 gam chất rắn. Giá trị của x và khối lượng của Fe trong hỗn hợp là:
Hướng dẫn:
Khối lượng chất rắn tăng = mCl đi vào muối Vì khi tăng HCl thì khối lượng chất rắn tăng ⇒ thí nghiệm đầu chắc chắn kim loại dư ⇒ 34,575 – 18,6 = 35,5.0,5x ⇒ x = 0,9 ⇒ nCl muối sau = 0,6 mol < nHCl sau = 0,72 mol ⇒ HCl dư ⇒ nFe + nZn = ½ nCl muối = 0,3 mol và 56nFe + 65nZn = 18,6g ⇒ nFe = 0,1 ⇒ mFe = 5,6g
3. Luyện tập Bài 23 Hóa học 10
Sau bài học cần nắm:
- Hiđro clorua là chất khí tan nhiều trong nước và có một số tính chất riêng, không giống với axit clohiđric (không làm đổi màu quỳ tím, không tác dụng với đá vôi).
- Tính chất chung của axit, axit clohiđric còn có tính chất riêng là tính khử do nguyên tố clo trong phân tử HCl có số oxi hoá thấp nhất là -1.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hiđro clorua - Axit clohiđric và muối clorua có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
Câu 1:
Để phân biệt dung dịch NaCl với dung dịch NaNO3 người ta dùng dung dịch nào dưới đây:
- A. Qùy tím
- B. Phenolphtalein
- C. AgNO3
- D. BaCl2
-
Câu 2:
Kim loại nào sau đây khi tác dụng với dung dịch HCl loãng và tác dụng với khí Cl2 cho cùng loại muối clorua kim loại?
- A. Zn.
- B. Cu.
- C. Ag.
- D. Fe
-
Câu 3:
Dãy nào sau đây gồm các chất đều tác dụng được với dung dịch HCl
- A. Fe2O3; KMnO4; Cu
- B. Zn; Al2O3 ; Ba(OH)2
- C. CaCO3; H2SO4; Mg(OH)2
- D. dd AgNO3; MgCO3; Ag
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hiđro clorua - Axit clohiđric và muối clorua.
Bài tập 1 trang 106 SGK Hóa học 10
Bài tập 2 trang 106 SGK Hóa học 10
Bài tập 3 trang 106 SGK Hóa học 10
Bài tập 4 trang 106 SGK Hóa học 10
Bài tập 5 trang 106 SGK Hóa học 10
Bài tập 6 trang 106 SGK Hóa học 10
Bài tập 7 trang 106 SGK Hóa học 10
Bài tập 23.1 trang 54 SBT Hóa học 10
Bài tập 23.2 trang 54 SBT Hóa học 10
Bài tập 23.3 trang 55 SBT Hóa học 10
Bài tập 23.4 trang 55 SBT Hóa học 10
Bài tập 23.5 trang 55 SBT Hóa học 10
Bài tập 23.6 trang 55 SBT Hóa học 10
Bài tập 23.7 trang 55 SBT Hóa học 10
Bài tập 23.8 trang 56 SBT Hóa học 10
Bài tập 23.9 trang 56 SBT Hóa học 10
Bài tập 23.10 trang 56 SBT Hóa học 10
Bài tập 23.11 trang 56 SBT Hóa học 10
Bài tập 23.12 trang 56 SBT Hóa học 10
Bài tập 1 trang 130 SGK Hóa học 10 nâng cao
Bài tập 2 trang 130 SGK Hóa học 10 nâng cao
Bài tập 3 trang 130 SGK Hóa học 10 nâng cao
Bài tập 4 trang 130 SGK Hóa học 10 nâng cao
Bài tập 5 trang 130 SGK Hóa học 10 nâng cao
Bài tập 6 trang 130 SGK Hóa học 10 nâng cao
4. Hỏi đáp về Bài 23 Chương 5 Hóa học 10
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
 NONE
NONE Bài học cùng chương
 Hoá học 10 Bài 21: Khái quát về nhóm halogen
Hoá học 10 Bài 21: Khái quát về nhóm halogen  Hoá học 10 Bài 22: Clo
Hoá học 10 Bài 22: Clo  Hoá học 10 Bài 24: Sơ lược về hợp chất có oxi của clo
Hoá học 10 Bài 24: Sơ lược về hợp chất có oxi của clo  Hoá học 10 Bài 25: Flo - Brom - Iot
Hoá học 10 Bài 25: Flo - Brom - Iot  Hoá học 10 Bài 27: Bài thực hành số 2 Tính chất hóa học của khí clo và hợp chất của Clo
Hoá học 10 Bài 27: Bài thực hành số 2 Tính chất hóa học của khí clo và hợp chất của Clo  Hoá học 10 Bài 28: Bài thực hành số 3 Tính chất hóa học của Brom và Iot ADSENSE TRACNGHIEM
Hoá học 10 Bài 28: Bài thực hành số 3 Tính chất hóa học của Brom và Iot ADSENSE TRACNGHIEM  Bộ đề thi nổi bật
Bộ đề thi nổi bật  UREKA AANETWORK
UREKA AANETWORK 
XEM NHANH CHƯƠNG TRÌNH LỚP 10
Toán 10
Toán 10 Kết Nối Tri Thức
Toán 10 Chân Trời Sáng Tạo
Toán 10 Cánh Diều
Giải bài tập Toán 10 Kết Nối Tri Thức
Giải bài tập Toán 10 CTST
Giải bài tập Toán 10 Cánh Diều
Trắc nghiệm Toán 10
Ngữ văn 10
Ngữ Văn 10 Kết Nối Tri Thức
Ngữ Văn 10 Chân Trời Sáng Tạo
Ngữ Văn 10 Cánh Diều
Soạn Văn 10 Kết Nối Tri Thức
Soạn Văn 10 Chân Trời Sáng tạo
Soạn Văn 10 Cánh Diều
Văn mẫu 10
Tiếng Anh 10
Giải Tiếng Anh 10 Kết Nối Tri Thức
Giải Tiếng Anh 10 CTST
Giải Tiếng Anh 10 Cánh Diều
Trắc nghiệm Tiếng Anh 10 KNTT
Trắc nghiệm Tiếng Anh 10 CTST
Trắc nghiệm Tiếng Anh 10 CD
Giải Sách bài tập Tiếng Anh 10
Vật lý 10
Vật lý 10 Kết Nối Tri Thức
Vật lý 10 Chân Trời Sáng Tạo
Vật lý 10 Cánh Diều
Giải bài tập Lý 10 Kết Nối Tri Thức
Giải bài tập Lý 10 CTST
Giải bài tập Lý 10 Cánh Diều
Trắc nghiệm Vật Lý 10
Hoá học 10
Hóa học 10 Kết Nối Tri Thức
Hóa học 10 Chân Trời Sáng Tạo
Hóa học 10 Cánh Diều
Giải bài tập Hóa 10 Kết Nối Tri Thức
Giải bài tập Hóa 10 CTST
Giải bài tập Hóa 10 Cánh Diều
Trắc nghiệm Hóa 10
Sinh học 10
Sinh học 10 Kết Nối Tri Thức
Sinh học 10 Chân Trời Sáng Tạo
Sinh học 10 Cánh Diều
Giải bài tập Sinh 10 Kết Nối Tri Thức
Giải bài tập Sinh 10 CTST
Giải bài tập Sinh 10 Cánh Diều
Trắc nghiệm Sinh học 10
Lịch sử 10
Lịch Sử 10 Kết Nối Tri Thức
Lịch Sử 10 Chân Trời Sáng Tạo
Lịch Sử 10 Cánh Diều
Giải bài tập Lịch Sử 10 KNTT
Giải bài tập Lịch Sử 10 CTST
Giải bài tập Lịch Sử 10 Cánh Diều
Trắc nghiệm Lịch sử 10
Địa lý 10
Địa Lý 10 Kết Nối Tri Thức
Địa Lý 10 Chân Trời Sáng Tạo
Địa Lý 10 Cánh Diều
Giải bài tập Địa Lý 10 KNTT
Giải bài tập Địa Lý 10 CTST
Giải bài tập Địa Lý 10 Cánh Diều
Trắc nghiệm Địa lý 10
GDKT & PL 10
GDKT & PL 10 Kết Nối Tri Thức
GDKT & PL 10 Chân Trời Sáng Tạo
GDKT & PL 10 Cánh Diều
Giải bài tập GDKT & PL 10 KNTT
Giải bài tập GDKT & PL 10 CTST
Giải bài tập GDKT & PL 10 CD
Trắc nghiệm GDKT & PL 10
Công nghệ 10
Công nghệ 10 Kết Nối Tri Thức
Công nghệ 10 Chân Trời Sáng Tạo
Công nghệ 10 Cánh Diều
Giải bài tập Công nghệ 10 KNTT
Giải bài tập Công nghệ 10 CTST
Giải bài tập Công nghệ 10 CD
Trắc nghiệm Công nghệ 10
Tin học 10
Tin học 10 Kết Nối Tri Thức
Tin học 10 Chân Trời Sáng Tạo
Tin học 10 Cánh Diều
Giải bài tập Tin học 10 KNTT
Giải bài tập Tin học 10 CTST
Giải bài tập Tin học 10 Cánh Diều
Trắc nghiệm Tin học 10
Cộng đồng
Hỏi đáp lớp 10
Tư liệu lớp 10
Xem nhiều nhất tuần
Đề thi giữa HK1 lớp 10
Đề thi giữa HK2 lớp 10
Đề thi HK1 lớp 10
Đề thi HK2 lớp 10
Video bồi dưỡng HSG môn Toán
Toán 10 Cánh Diều Bài tập cuối chương 1
Toán 10 Chân trời sáng tạo Bài 2: Tập hợp
Toán 10 Kết nối tri thức Bài 1: Mệnh đề
Soạn bài Ra-ma buộc tội - Ngữ văn 10 Tập 1 Cánh Diều
Soạn bài Chữ người tử tù - Nguyễn Tuân - Ngữ văn 10 KNTT
Soạn bài Thần Trụ Trời - Ngữ văn 10 CTST
Văn mẫu về Cảm xúc mùa thu (Thu hứng)
Văn mẫu về Bình Ngô đại cáo
Văn mẫu về Chữ người tử tù
Văn mẫu về Tây Tiến
YOMEDIA YOMEDIA ×Thông báo
Bạn vui lòng đăng nhập trước khi sử dụng chức năng này.
Bỏ qua Đăng nhập ×Thông báo
Bạn vui lòng đăng nhập trước khi sử dụng chức năng này.
Đồng ý ATNETWORK ON QC Bỏ qua >>
QC Bỏ qua >> 
Từ khóa » Công Thức Electron Của Clorua
-
Chlor
-
Công Thức Electron Của Cl2 Là :
-
Công Thức Electron Của Cl2 Là :Cl:Cl:
-
[LỜI GIẢI] Chọn Công Thức Electron đúng Của Phân Tử Hiđro Clorua
-
Chloride – Wikipedia Tiếng Việt
-
Tính Chất Hóa Học Của Clo (Cl), Bài Tập Về Clo - Hóa 10 Bài 22
-
Liên Kết Hoá Học
-
Giải Bài Tập Hóa 10 Bài 13: Liên Kết Cộng Hóa Trị
-
Top 14 Công Thức Electron Của Hcl - Thư Viện Hỏi Đáp
-
Cách Viết Công Thức Cấu Tạo Của Các Phân Tử
-
(PDF) Chuyen De Hoa Vo Co | Bogle San
-
Dề Cương On Tập Hoa Nc Lớp 10
-
Bài 13.12 Trang 33 SBT Hóa Học 10