Liên Kết Cộng Hóa Trị Có Cực, Không Cực, Phân Loại Liên Kết Hóa Học ...
Có thể bạn quan tâm
Nội dung bài viết này sẽ giúp các em hiểu rõ: Sự hình thành liên kết cộng hóa trị trong phân tử đơn chất và hợp chất? Sự phân cực trong liên kết cộng hóa trị như thế nào? Và cách phân loại các loại liên kết hóa học theo hiệu độ âm điện?
I. Sự hình thành liên kết cộng hóa trị
- Định nghĩa: Liên kết cộng hóa trị là liên kết được hình thành giữa 2 nguyên tử bằng một hay nhiều cặp electron dùng chung.
1. Sự hình thành liên kết cộng hóa trị trong phân tử đơn chất
a) Sự hình thành phân tử hiđro (H2)
- Hai nguyên tử H góp 1 electron tạo thành một cặp electron chung trong phân tử H2![]() - Công thức H:H được gọi là công thức electron
- Công thức H:H được gọi là công thức electron
- Công thức H-H được gọi là công thức cấu tạo
b) Sự hình thành phân tử nito (N2)
- Mỗi nguyên tử N góp chung 3 electron để tạo thàn 3 cặp electron chung của phân tử N2![]() - Hai nguyên tử N liên kết với nhau bằng 3 cặp e, liên kết biểu thị bằng ba gạch (≡), đó là liên kết 3. Liên kết ba này bền nên ở nhiệt độ thường khí nitơ kém hoạt động hóa học.
- Hai nguyên tử N liên kết với nhau bằng 3 cặp e, liên kết biểu thị bằng ba gạch (≡), đó là liên kết 3. Liên kết ba này bền nên ở nhiệt độ thường khí nitơ kém hoạt động hóa học.
→ Các phân tử H2, O2, N2, Cl2,... tạo nên từ hai nguyên tử của cùng một nguyên tố (có độ âm điện như nhau) nên cặp electron chung không bị lệch về phía nguyên tử nào. Đó là liên kết cộng hóa trị không cực.
2. Sự hình thành liên kết cộng hóa trị trong phân tử hợp chất
a) Sự hình thành phân tử hidro clorua (HCl)
- Trong phân tử hiđro, mỗi nguyển tử (H và Cl) góp 1 electron tạo thành một cặp electron chung để tạo liên kết cộng hóa trị. Cặp electron liên kết bị lệch về phía Clo, ( Độ âm điện của Cl là 3,5 lớn hơn độ âm điện của H là 2,1 ) liên kết cộng hóa trị này bị phân cực.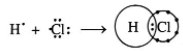
 - Vậy HCl là liên kết cộng hóa trị có cực
- Vậy HCl là liên kết cộng hóa trị có cực
b) Sự hình thành phân tử khí cacbon đioxit (CO2)
- Trong phân tử CO2, nguyên tử C nằm giữa 2 nguyên tử O và nguyên tử C góp chung với mỗi nguyên tử O hai electron.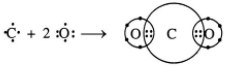
![]() - Trong phân tử CO2 các cặp electron bị hút lệch về phía O vì oxi có độ âm điện lớn hơn C nên liên kết C=O bị phân cực về phía O
- Trong phân tử CO2 các cặp electron bị hút lệch về phía O vì oxi có độ âm điện lớn hơn C nên liên kết C=O bị phân cực về phía O
- Trong phân tử CO2 có cấu tạo thẳng nên liên kết đôi phân cực (C=O) triệt tiêu nhau dẫn đến phản tử CO2 không phân cực.
3. Tính chất của các chất có liên kết cộng hóa trị
• Trạng thái: Các chất mà phân tử chỉ có liên kết cộng hóa trị có thể là:
+ Các chất rắn: đường, lưu huỳnh, iot,...
+ Các chất lỏng: nước, rượu, xăng, dầu,...
+ Các chất khí: khí cacbonic, khí clo, khí hiđro,...
• Tính tan:
+ Các chất có cực như rượu etylic, đường,... tan nhiều trong dung môi có cực như nước.
+ Phần lớn các chất không cực như lưu huỳnh, iot, các chất hữu cơ không cực tan trong dung môi không cực như benzen, cacbon tetraclorua,...
Nói chung, các chất có liên kết cộng hóa trị không cực không dẫn điện ở mọi trạng thái.
II. Độ âm điện và liên kết hóa học
1. Quan hệ giữa liên kết cộng hóa trị không cực, liên kết cộng hóa trị có cực và liên kết ion
- Trong phân tử, nếu cặp electron chung ở giữa 2 nguyên tử, ta có liên kết cộng hóa trị không cực.
- Nếu cặp electron chung lệch về 1 nguyên tử (có giá trị độ âm điện lớn hơn) thì đó là liên kết cộng hóa trị có cực.
- Nếu cặp electron chung chuyển hẳn về 1 nguyên tử, ta sẽ có liên kết ion.
2. Hiệu độ âm điện và liên kết hóa học
- Người ta phân loại một cách tương đối loại liên kết hóa học theo quy ước kinh nghiệm dựa vào thang độ âm điện của Pau-linh như sau:
| Hiệu độ âm điện (Δχ) | Loại liên kết |
| 0 ≤ Δχ < 0,4 | Liên kết cộng hóa trị không cực |
| 0,4 ≤ Δχ < 1,7 | Liên kết cộng hóa trị có cực |
| Δχ ≥ 1,7 | Liên kết ion |
* Thí dụ:
a) Trong NaCl:
Δχ = 3,16 − 0,93 = 2,23 > 1,7
⟶Liên kết giữa Na và Cl là liên kết ion.
b) Trong phân tử HCl:
Δχ = 3,16 − 2,2 = 0,96
⟶ 0,4 ≤ Δχ < 1,7
⟶ Liên kết giữa H và Cl là liên kết cộng hóa trị có cực.
c) Trong phân tử H2 :
Δχ = 2,20 − 2,20 = 0,0
⟶ 0 ≤ Δχ < 0,4
⟶ Liên kết giữa H và H là liên kết cộng hóa trị không cực.
Từ khóa » Khoảng Hiệu độ âm điện Cho Biết Liên Kết Thuộc Loại Cộng Hóa Trị Không Cực
-
Lý Thuyết Về Hiệu độ âm điện Và Liên Kết Hóa Học - Lớp 10 - HOCMAI
-
Lý Thuyết Hiệu độ âm điện Và Liên Kết Hóa Học Hay, Chi Tiết Nhất
-
Bài 21: Hiệu độ âm điện Và Liên Kết Hóa Học (Nâng Cao)
-
Dựa Vào Hiệu độ âm điện Của Các Nguyên Tố, Hãy Cho Biết Loại Liên ...
-
Cách để Tính độ âm điện - WikiHow
-
Bài 21: Hiệu độ âm điện Và Liên Kết Hóa Học
-
Mối Liên Hệ Giữa Hiệu độ âm điện Và Liên Kết Hóa Học
-
Bài 21. Hiệu độ âm điện Và Liên Kết Hóa Học
-
[CHUẨN NHẤT] Hiệu độ âm điện Của O2 - TopLoigiai
-
Chương 3. Liên Kết Hóa Học - Hoc24
-
Dựa Vào Hiệu độ âm điện Của Các Nguyên Tố, Hãy Cho Biết ... - Hoc24
-
Liên Kết Cộng Hóa Trị Là Gì, Liên Kết Cộng Hóa Trị Có Cực Và Không Cực
-
Hãy Cho Biết Thế Nào Là Liên Kết Cộng Hóa Trị Không Cực
-
Tiết 29 Bài 21: Hiệu độ âm điện Và Liên Kết Hóa Học