Liên Kết Ion Là Gì, được Hình Thành Như Thế Nào? Giải đáp Chi Tiết Nhất
Định nghĩa ion và liên kết ion là gì?
Trong phần này, chúng ta cần nắm chắc những định nghĩa cơ bản về ion, liên kết ion và phân loại của chúng.
Định nghĩa về ion và liên kết ion
- Khái niệm Ion: Ion (điện tích) là quá trình một nhóm nguyên tử hay nguyên tử tử bị mất hoặc nhận thêm một hay nhiều electron.
- Khái niệm liên kết ion: Liên kết ion, hay liên kết điện tích, là một liên kết hóa học có bản chất là lực hút tĩnh điện giữa hai ion mang điện tích trái dấu. Liên kết ion thường là liên kết giữa các nguyên tử nguyên tố phi kim với các nguyên tử nguyên tố kim loại. Các nguyên tử kim loại có độ âm điện nhỏ, dễ mất electron tạo ra ion dương. (Theo Wikipedia)
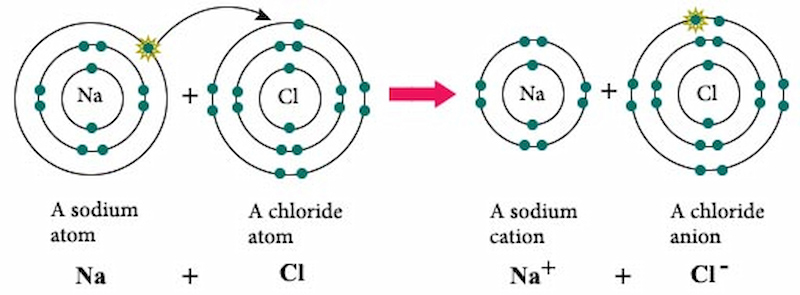
Phân loại ion dương (cation) và ion âm (anion)
Ion được chia làm 2 loại là ion dương cation và ion âm anion. Cụ thể, trong quá trình ion hóa một nguyên tử hay nhóm nguyên tử sẽ nhận thêm hoặc mất bớt đi các electron tạo thành các cation hoặc anion.
-
Anion là các ion có điện tích âm được hình thành bởi các nguyên tử trung tính. Khi một nguyên tử trong quá trình ion hóa hút một hoặc nhiều electron vào trong nó, các ion được hình thành. Thông thường, các anion được hình thành bởi các nguyên tố phi kim, ví dụ Oxy tạo thành anion -2, Clo tạo thành anion -1,... Do các nguyên tử này có độ âm điện rất lớn, chúng hút các electron và tạo thành các anion.
-
Cation là các ion mang điện tích dương được hình thành khi các nguyên tử hoặc nhóm nguyên tử trung tính mất đi các electron. Khi bỏ các electron, số lượng proton trong hạt nhân cao hơn, do đó nguyên tử được tích điện dương. Các Cation được hình thành từ kim loại tại nhóm S trong bảng tuần hoàn hóa học. Do các Cation các các kích thước điện tích khác nhau tùy thuộc vào số lượng electron mất đi mà hình thành lên các Cation khác nhau như: Ca2+, Al3+,...
Ion đơn nguyên tử và đa nguyên tử là gì?
- Ion đơn nguyên tử là ion có duy nhất một nguyên tử, mang điện tích âm hoặc dương. Ví dụ: Mg2+. Al3+, Cl-, F-,...
- ion đa nguyên tử là ion được tạo ra bởi nhiều nguyên tử liên kết với nhau để tạo thành nhóm nguyên tử.
Ví dụ về liên kết ion NO3-. SO42-, NH4+,...
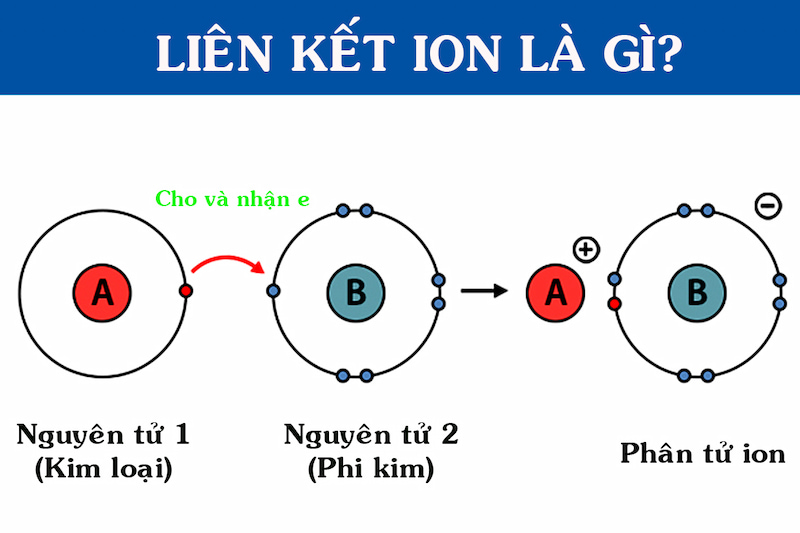
Liên kết ion được hình thành như thế nào?
Như chúng ta đã biết, liên kết ion là là liên kết được tạo thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Ví dụ liên kết ion như sau: Na+ + Cl- → NaCl. Liên kết giữa Na+ và Cl- là một liên kết ion.

Điều kiện hình thành
Liên kết ion chỉ được hình thành khi có 2 điều kiện sau:
-
Liên kết được hình thành bởi các nguyên tố có tính chất khác hẳn nhau (giữa kim loại và phi kim).
-
Trừ một số trường hợp điển hình, hiệu độ âm điện giữa 2 nguyên tử liên kết ion phải >= 1,7.
Dấu hiệu nhận biết phân tử có liên kết ion
Chúng ta có thể dựa vào các dấu hiệu dưới đây để nhận biết một liên kết ion:
-
Phân tử hợp chất được hình thành từ kim loại điện hình đến phi kim điển hình. Ví dụ: NaCl, CaCl2, BaF2,... Các hợp chất này đều chứa liên kết ion- liên kết được hình thành giữa anion phi kim và anion kim loại.
-
Phân tử chứa hợp chất muối và cation hoặc anion đa nguyên tử.
Ví dụ: MgSO4, NH4Cl,... Đây đều là liên kết ion - liên kết này được hình thành giữa anion phi kim và cation kim loại và anion gốc axit.
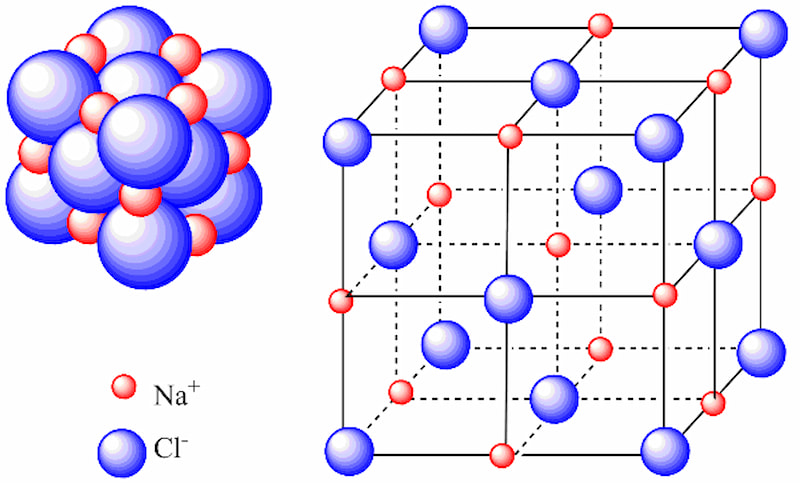
Cấu trúc mạng tinh thể của liên kết ion
Cấu trúc mạng tinh thể của liên kết ion là sự kết hợp của nhiều phân tử ion thành một liên kết khổng lồ. Và sự sắp xếp theo một cấu trúc hình học này được gọi là mạng tinh thể.
Ví dụ: NaCl không chứa một ion Na và một ion Cl, liên kết ion này là sự sắp xếp của nhiều ion Na+ và Cl- thành mạng lưới tinh thể, có tỉ lệ 1-1.
Tính chất của hợp chất có liên kết ion
Từ đặc trưng của liên kết ion có thể thấy rằng, các hợp chất có liên kết ion sẽ thường mang những tính chất phổ biến như:
-
Trạng thái: Chất rắn ion tồn tại ở nhiệt độ phòng và ở dạng tinh thể.
-
Cấu trúc: Thông thường ion được sắp xếp theo cấu trúc mạng tinh thể.
-
Tính dẫn điện: Ở tinh thể rắn, ion không dẫn điện, nhưng ở dạng dung dịch thì dẫn điện.
-
Dễ vỡ khi gặp áp lực: Khi bị đặt dưới áp lực, các hợp chất của ion dễ vỡ đồng thời liên kết bị phá vỡ dọc theo các mặt phẳng.
-
Lực hút tĩnh điện: Liên kết ion là liên kết có lực hút tĩnh điện mạnh. Do đó, hợp chất ion thường được biết đến là rất cứng, nhiệt độ nóng chảy và nhiệt độ sôi cao do liên kết ion tương đối bền vững. Ví dụ: NaCl có nhiệt độ nóng chảy là 800 độ, MgO là 2800 độ.
-
Dẫn điện: Ở trạng thái nóng chảy và khi tan trong dung dịch. Ở trạng thái rắn thường không dẫn điện.
Các bài viết không thể bỏ lỡ Monkey Math - Ứng dụng học toán tiếng Anh chỉ với 2K/Ngày Sự điện li là gì? Lý thuyết và giải bài tập chi tiết Số oxi hóa là gì? 4 quy tắc xác định số oxi hóa của 1 nguyên tố

Liên kết ion và liên kết cộng hóa trị khác nhau như thế nào?
Đều là liên kết xảy ra trong quá trình phản ứng hóa học, nhưng đâu là sự khác biệt giữa liên kết ion và liên kết cộng hóa trị?
Chúng ta cùng tìm hiểu sự khác nhau này thông qua định nghĩa, bản chất liên kết và hiệu độ âm điện trong bảng so sánh sau:
| Loại liên kết | Liên kết ion | Liên kết cộng hóa trị |
| Định nghĩa | Liên kết được hình thành bởi lực hút tĩnh điện tạo liên kết giữa các ion mang điện tích trái dấu. | Liên kết được hình thành giữa 2 nguyên tử sử dụng chung 1 hoặc nhiều cặp electron. |
| Bản chất của liên kết | Bản chất của liên kết ion là sự dịch chuyển electron từ nguyên tử này sang nguyên tử khác. | Bản chất của liên kết cộng hóa trị là quá trình sử dụng một hoặc nhiều cặp electron chung. |
| Hiệu độ âm điện | Có hiệu độ âm điện >=1,7. | 0 < Hiệu độ âm điện <1,7. |
Hướng dẫn giải một số bài tập về liên kết ion SGK Hóa học 10 kèm lời giải
Cùng áp dụng những kiến thức đã học trên để thực hành một số bài tập Hóa học 10 về liên kết ion sau đây:
Bài 1 (trang 59 SGK Hóa 10):
Liên kết hóa học trong NaCl được hình thành là do:
A. Hai hạt nhân nguyên tử hút electron rất mạnh.
B. Mỗi nguyên tử Na và Cl góp chung 1 electron.
C. Mỗi nguyên tử đó nhường hoặc thu electron để trở thành các ion trái dấu hút nhau.
D. Na → Na+ e ; Cl + e → Cl- ; Na+ + Cl- → NaCl.
Chọn đáp án đúng nhất
Đáp án: D đúng
Bài 2 (trang 59 SGK Hóa 10):
Muối ăn ở thể rắn là:
A. Các phân tử NaCl
B. Các ion Na+ và Cl-
C. Các tinh thể hình lập phương: các ion Na+ và Cl- được phân bố luân phiên đều đặn trên mỗi đỉnh.
D. Các tinh thể hình lập phương: các ion Na+ và Cl- được phân bố luân phiên đều đặn thành từng phân tử riêng rẽ.
Chọn đáp án đúng nhất.
Đáp án: C đúng
Bài 3 (trang 60 SGK Hóa 10):
a) Viết cấu hình electron của cation liti (Li+) và anion oxit (O2-).
b) Những điện tích ở ion Li+ và O2- do đâu mà có?
c) Nguyên tử khí hiếm nào có cấu hình electron giống Li+ và nguyên tử khí hiếm nào có cấu hình electron giống O2-.
d) Vì sao 1 nguyên tử oxi kết hợp được với 2 nguyên tử liti?
Đáp án:
a) Cấu hình electron của cation liti (Li+) là 1s2 và anion oxit (O2-) là 1s22s22p6.
b) Điện tích ở Li+ do mất 1e mà có, điện tích ở O2- do O nhận thêm 2e mà có.
c) Nguyên tử khí hiếm He có cấu hình electron giống Li+
Nguyên tử khí hiếm Ne có cấu hình electron giống O2-
d) Vì mỗi nguyên tử liti chỉ có thể nhường 1e, mà một nguyên tử oxi thu 2e.
2Li → 2Li+ + 2e;
O + 2e → O2-;
2Li+ + O2- → Li2O.
Bài 4 (trang 60 SGK Hóa 10):
Đề bài:
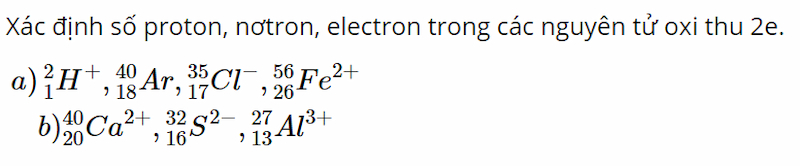
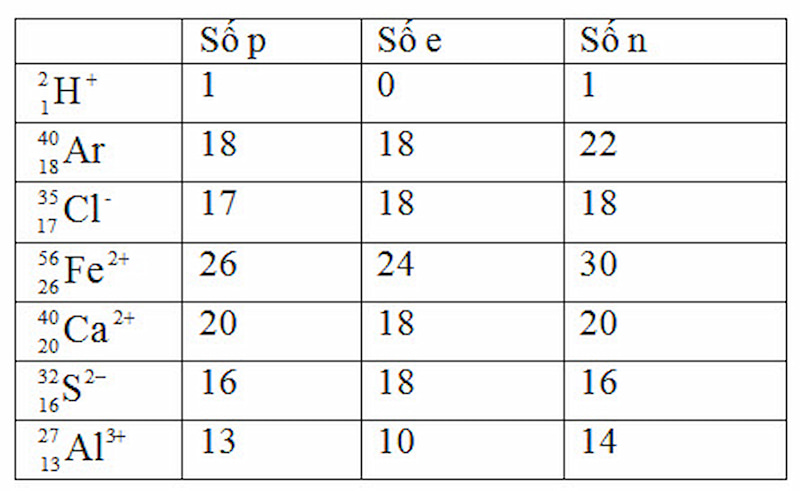
Lời giải:
| GIÚP CON HỌC TOÁN KẾT HỢP VỚI TIẾNG ANH SIÊU TIẾT KIỆM CHỈ TRÊN MỘT APP MONKEY MATH. VỚI NỘI DUNG DẠY HỌC ĐA PHƯƠNG PHÁP GIÚP BÉ PHÁT TRIỂN TƯ DUY NÃO BỘ VÀ NGÔN NGỮ TOÀN DIỆN CHỈ VỚI 2K/NGÀY.
|
Bài tập về liên kết ion để học sinh thực hành
Ngoài bài tập trong sách giáo khoa hóa học 10, dưới đây là một số bài tập liên quan mà Monkey tổng hợp để các em cùng nhau luyện tập:
I/ PHẦN TRẮC NGHIỆM
Câu 1: Liên kết ion là liên kết hóa học được hình thành bằng lực hút tĩnh điện giữa
A. Anion và electron tự do
B. Các ion mang điện tích cùng dấu
C. Hạt nhân của nguyên tử này và hạt nhân của nguyên tử kia
D. Cation và anion
Câu 2: Loại hạt nào sau đây tham gia vào quá trình liên kết hóa học?
A. Hạt electron
B. Hạt notron
C. Hạt proton
D. Hạt nhân nguyên tử
Câu 3: Liên kết ion được tạo thành giữa
A. hai nguyên tử kim loại.
B. hai nguyên tử phi kim.
C. một nguyên tử kim loại mạnh và một nguyên tử phi kim mạnh.
D. một nguyên tử kim loại yếu và một nguyên tử phi kim yếu.
Câu 4: Dãy chất nào sau đây mà phân tử chỉ chứa liên kết ion?
A. KCl; MgO; BaCl2
B. BaCl2; MgO; H2O
C. NaBr; Na2O; KNO3
D. SO2; H2SO4; HClO4
Câu 5: Trong tinh thể NaCl, nguyên tố Na và Cl ở dạng ion và có sô electron lần lượt là
A. 10 và 18
B. 12 và 16
C. 10 và 10
D. 11 và 17
Câu 6: Mạng tinh thể ion có đặc tính nào dưới đây?
A. Bền vững, nhiệt độ nóng chảy cao và nhiệt độ sôi thấp
B. Bền vững, nhiệt độ nóng chảy và nhiệt độ sôi khá cao
C. Bền vững, nhiệt độ nóng và nhiệt độ sôi thấp
D. Dễ bay hơi
Câu 7: Phân tử nào sau đây có liên kết phân cực nhất?
A. F2O
B. Cl2O
C. ClF
D. O2
Câu 8: Phát biểu nào sau đây là không đúng?
A. Liên kết ion là liên kết được tạo thành do sự nhận electron
B. Liên kết ion là liên kết giữa 2 nguyên tử có hiệu độ âm điện lớn hơn 1
C. Liên kết ion là liên kết được hình thành do sự góp chung electron.
D. Liên kết ion được hình thành nhờ lực hút tĩnh điện giữa ion mang điện tích trái dấu
Câu 9: Liên kết trong phân tử chất nào sau đây mang nhiều tính chất của liên kết ion nhất?
A. LiCl
B. NaCl
C. KCl
D. CsCl
Câu 10: Năng lượng ion hóa của nguyên tử là:
A. Năng lượng giải phóng bởi nguyên tử khi tạo liên kết ion
B. Năng lượng giải phóng khi nguyên tử nhận thêm electron
C. Năng lượng cần để tách electron ra khỏi nguyên tử ở trạng thái cơ bản
D. Năng lượng cần để cung cấp để nguyên tử nhận thêm electron
II/ PHẦN TỰ LUẬN
Câu 1. Hãy viết công thức electron và công thức cấu tạo của các phân tử sau: PH3, SO2
Câu 2. Viết công thức electron, công thức cấu tạo của HClO, HCN, HNO2.
Câu 3. Viết công thức cấu tạo của các phân tử và ion sau: H2SO3, Na2SO4, HClO4, CuSO4, NaNO3, CH3COOH, NH4NO3, H4P2O7.
Câu 4. Viết công thức electron, công thức cấu tạo của các phân tử:NH3, C2H2, C2H4, CH4, Cl2, HCl, H2O.
Câu 5. Viết công thức cấu tạo của các phân tử và ion sau: NH4+, Fe3O4, KMnO4, Cl2O7
Câu 6. Viết công thức electron và công thức cấu tạo các chất sau:HNO3, Al(OH)3, K2Cr2O7, N2O5, Al2S3, H2CrO4, PCl5
Câu 7: Xác định số oxi hóa của các nguyên tố trong hợp chất , đơn chất và ion sau:
a) H2S, S, H2SO3, H2SO4.
b) HCl, HClO, NaClO2, HClO3.
c) Mn, MnCl2, MnO2, KMnO4.
Cho các phân tử sau : C2H2 (1) ; BF3 (2) ; BeCl2 (3) ; C2H4 (4) ; CH4 (5) ; Cl2 (6) ; H2 (7) ; H2O (8) ; NH3 (9) ; HCl (10). Trong các phân tử trên, sự hình thành liên kết trong các phân tử nhờ :
a. Sự lai hoá sp các AO hoá trị là :
A. (1), (3), (6).
B. (1), (2), (3), (5).
C. (1), (3), (4), (7).
D. (1), (3).
b. Sự lai hoá sp2 các AO hoá trị là :
A. (2), (4).
B. (2), (6).
C. (2), (3), (4).
D. A, B, C.
b. Sự lai hoá sp3 các AO hoá trị là :
A. (5), (6), (8), (10).
B. (5), (8), (9).
C. (3), (5), (8), (9).
D. (5), (6), (8), (9).
Câu 8: Cho độ âm điện Cs : 0,79 ; Ba : 0,89 ; H : 2,2 ; Cl : 3,16 ; S : 2,58 ; N : 3,04 ; O : 3,44 để xét sự phân cực của liên kết trong phân tử các chất sau: NH3 , H2S, H2O, CsCl . Chất nào trong các chất trên có liên kết ion ?
Câu 9: X, A, Z là những nguyên tố có số điện tích hạt nhân là 9, 19, 8.
a) Viết cấu hình electron nguyên tử của các nguyên tố đó.
b) Dự đoán liên kết hóa học có thể có giữa các cặp X và A, A và Z, Z và X.
Câu 10: Cho độ âm điện: Be (1,5), Al (1,5), Mg (1,2), Cl (3,0), N (3,0), H (2,1), S (2,5), O (3,5). Chất nào sau đây có liên kết ion ?
| Với việc sở hữu Kho trò chơi và video, giọng đọc, hình ảnh minh họa sinh động, hấp dẫn. Luôn đổi mới, cập nhật thường xuyên - tăng hứng thú học cho trẻ khi học tiếng Anh cùng Monkey Junior chỉ với 2K/ngày.
|
Bài viết trên đây đã cung cấp những lý thuyết chi tiết nhất về liên kết ion cùng bài tập thực hành trong SGK Hóa học 10. Hy vọng bạn có thêm nhiều kiến thức bổ ích xung quanh ion, liên kết ion và quá trình tiếp thu bài học hiệu quả. Truy cập website của Monkey mỗi ngày để có thêm nhiều thông tin thú vị về môn Hóa học nhé!
Từ khóa » Tính Ion Cao Nhất
-
Liên Kết Ion – Wikipedia Tiếng Việt
-
Tinh Thể Ion – Wikipedia Tiếng Việt
-
Công Thức Của Hợp Chất Ion Hoạt động Như Thế Nào
-
Liên Kết Ion Là Gì? Sự Hình Thành Liên Kết Ion Như Thế Nào?
-
Lý Thuyết Liên Kết Ion - Tinh Thể Ion | SGK Hóa Lớp 10
-
Đặc điểm Liên Kết Ion, Cách Thức Hình Thành, Phân Loại Và Ví Dụ
-
Tính Chất Vật Lý Của Kim Loại - Thầy Phạm Ngọc Dũng Dạy HÓA
-
LiCl, NaCl, KCl, RbCl, CsCl Liên Kết Trong Phân Tử Mang Nhiều Tính ...
-
Trắc Nghiệm Hóa 10 Bài 12: Liên Kết Ion Tinh Thể Ion - TopLoigiai
-
Hấp Thu Thuốc - Dược Lý Lâm Sàng - Phiên Bản Dành Cho Chuyên Gia
-
Độ PH Là Gì? PH Trong Cơ Thể ở Mức Bao Nhiêu?