Lý Thuyết Hóa 12: Bài 31. Sắt - TopLoigiai
Có thể bạn quan tâm
Lý thuyết Hóa 12 Bài 31. Sắt
I. Vị trí trong bảng tuần hoàn, cấu hình electron nguyên tử
Sắt (Fe) ở ô số 26, thuộc nhóm VIIIB, chu kì 4 của bảng tuần hoàn.
Cấu hình electron nguyên tử :
1s22s22p63s23p63d64s2, có thể viết gọn là [Ar]3d64s2.
Nguyên tử sắt dễ nhường 2 electron ở phân lớp 4s trở thành ion Fe2+ và có thể nhường thêm 1 electron ở phân lớp 3d trở thành ion Fe3+.
II. Tính chất vật lí
Sắt là kim loại màu trắng hơi xám, có khối lượng riêng lớn (D = 7,9 g/cm3), nóng chảy ở 1540oC. Sắt có tính dẫn điện, dẫn nhiệt tốt và có tính nhiễm từ.
III. Tính chất hóa học
Sắt có tính khử trung bình. Khi tác dụng với chất oxi hóa yếu, sắt bị oxi hóa đến số oxi hóa +2.
Với chất oxi hóa mạnh, sắt bị oxi hóa đến số oxi hóa +3.
1. Tác dụng với phi kim
Ở nhiệt độ cao, sắt khử nguyên tử phi kim thành ion âm và bị oxi hóa đến số oxi hóa +2 hoặc +3.
- Tác dụng với lưu huỳnh
Khi đun nóng, Fe khử S xuống số oxi hóa -2, còn sắt bị oxi hóa đến số oxi hóa +2.
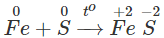
- Tác dụng với oxi
Khi đun nóng, Fe khử O2 đến số oxi hóa -2, còn Fe bị oxi hóa đến số oxi hóa +2 và +3.
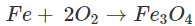
- Tác dụng với clo
Fe khử Cl2 đến số oxi hóa -1, còn Fe bị oxi hóa đến số oxi hóa +3.
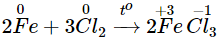
2. Tác dụng với axit
- Với dung dịch HCl, H2SO4 loãng
Fe khử ion H+ của các dung dịch HCl, H2SO4 loãng thành H2, Fe bị oxi hóa đến số oxi hóa +2.
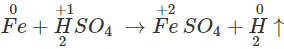
- Với dung dịch HNO3 và H2SO4 đặc, nóng
Fe khử
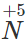
hoặc
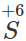
trong dung dịch HNO3 hoặc H2SO4 đặc, nóng đến số oxi hóa thấp hơn, còn Fe bị oxi hóa đến số oxi hóa +3.
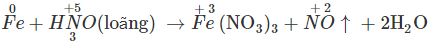
Fe bị thụ động bởi các axit HNO3 đặc, nguội hoặc H2SO4 đặc, nguội.
3. Tác dụng với dung dịch muối
Fe có thể khử được ion của các kim loại đứng sau nó trong dãy điện hóa của kim loại.
Thí dụ :
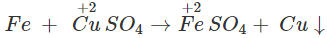
4. Tác dụng với nuớc
Ở nhiệt độ cao sắt khử hơi nước tạo ra H2 và Fe3O4 hoặc FeO.
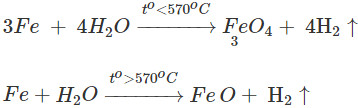
IV. Trạng thái tự nhiên
Sắt chiếm 5% khối lượng vỏ Trái Đất, đứng thứ hai trong các kim loại (sau nhôm).
Sắt tồn tại chủ yếu ở dạng hợp chất.
Quặng sắt quan trọng là: quặng manhetit (Fe3O4) (hiếm có trong tự nhiên), quặng hematit đỏ (Fe2O3), quặng hematit nâu (Fe2O3.nH2O), quặng xiđerit (FeCO3), quặng pirit (FeS2).
Sắt có trong hemoglobin (huyết cầu tố) của máu, làm nhiệm vụ vận chuyển oxi, duy trì sự sống.
Những thiên thạch từ khoảng không của Vũ Trụ rơi vào Trái Đất có chứa sắt tự do.
Xem thêm Giải Hóa 12: Bài 31. Sắt
Từ khóa » Sơ đồ Tư Duy Bài 31 Hoá 12
-
Sơ đồ Tư Duy Hóa Học 12 đầy đủ Và Chi Tiết - Tintuctuyensinh
-
Giáo án Hóa Học 12 Bài 31: Sắt - Tài Liệu Text - 123doc
-
Sơ đồ Tư Duy Hóa 12 Ngắn Gọn, Dễ Học [HOT] - .vn
-
Lớp 12- Sơ đồ Tư Duy Của Sắt Và Hợp Chất - Ghi Nhớ Thông Minh Nhất
-
Sơ đồ Tư Duy Hóa Học Lớp 12 Cập Nhật Mới Nhất - Tuyển Sinh Số
-
Sơ đồ Tư Duy Este Lớp 12 - Chia Sẻ Kiến Thức Mỗi Ngày - Chiase24
-
Sơ đồ Tư Duy Hóa 12 Chương 7 - THPT Ninh Châu Quảng Bình
-
Hoá Học 12 Bài 31: Sắt - Hoc247
-
Sơ đồ Tư Duy Hóa Học Lớp 12 Cập Nhật Mới Nhất
-
Tiến Hóa Lớn Sinh 12 | SGK Sinh Lớp 12
-
Sơ đồ Tư Duy Hóa 12 Chương 1
-
Sơ đồ Tư Duy Hóa Học 12 - Thông Tin Thế Giới Số Internet