Tính Chất Hoá Học Của Axit Nitric HNO3, Ví Dụ Và Bài Tập - Hoá Lớp 11
Có thể bạn quan tâm
Vậy HNO3 - axit nitric và các hợp chất muối nitrat có những tính chất hoá học và tính chất vật lý đặc trưng gì, bài viết dưới đây chúng ta cùng tìm hiểu chi tiết về tính chất hoá học của axit nitric và mối nitrat.
> Tính chất hóa học của muối Nitrat - Hóa 11 bài 9
I. Tính chất vật lý của Axit Nitric
+ Axit nitric tinh khiết là chất lỏng, không màu, bốc khói mạnh trong không khí ẩm, D=1,53 g/cm3
+ Axit nitric kém bền. Ngay ở điều kiện thường, khi có ảnh sáng, dung dịch axit nitric bị phân hủy một phần giải phóng nitơ đioxit. Khí này tan trong dung dịch axit làm dung dịch có màu vàng.
+ Axit nitric tan trong nước ở bất kì tỉ lệ nào. Trong phòng thí nghiệm thường có loại HNO3 nồng độ 68%, D=1,40 g/cm3
Về tính chất hoá học của Axit nitric:
- Tác dụng với Bazơ
- Tác dụng với Oxit bazơ
- Tác dụng với Muối
- Tác dụng với Kim loại
- Tác dụng với phi kim
Dưới đây, chúng ta cùng tìm hiểu chi tiết về tính chất hoá học của axit nitric.

II. Tính chất hoá học của Axit Nitric
1. Axit Nitric thể hiện tính axit
* HNO3 là một axit mạnh (do HNO3 phân ly thành H+ và NO3-)
a) Axit Nitric làm quỳ tím chuyển thành màu đỏ.
b) Axit Nitric tác dụng với oxit bazơ (trong đó kim loại đã đạt hóa trị cao nhất) → muối + H2O:
• HNO3 + CuO
2HNO3 + CuO → Cu(NO3)2 + H2O
c) Axit Nitric tác dụng với bazơ (trong đó kim loại đã đạt hóa trị cao nhất) → Muối + H2O:
• HNO3 + NaOH
HNO3 + NaOH → NaNO3 + H2O
• HNO3 + KOH
HNO3 + KOH → KNO3 + H2O
• HNO3 + Mg(OH)2
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
d) Axit Nitric tác dụng với muối (trong muối kim loại đã đạt hóa trị cao nhất) → muối mới + axit mới:
• HNO3 + CaCO3
2HNO3 + CaCO3 → Ca(NO3)2 + CO2↑ + H2O
2. Axit Nitric thể hiện tính oxi hoá
* HNO3 có số oxi hoá là +5 (có tính oxi hoá mạnh) nên tuỳ vào nồng độ của HNO3 và khả năng khử của chất tham gia có thể bị khử thành: 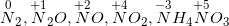
a) Axit Nitric tác dụng với kim loại:
- HNO3 phản ứng với hầu hết các kim loại trừ Au và Pt → muối nitrat + H2O và sản phẩm khử của N+5 (NO2, NO, N2O, N2 và NH4NO3).
PTPƯ: M + HNO3 → M(NO3)n + H2O + NO2 (NO, N2O, N2, NH4NO3)
- Sản phẩm khử của N+5 là tùy thuộc vào độ mạnh của kim loại và nồng độ của dung dịch axit, thông thường thì:
- Dung dịch HNO3 đặc tác dụng với kim loại → NO2;
- Dung dịch HNO3 loãng tác dụng với kim loại khử yếu (như: Cu, Pb, Ag,..) → NO;
- Dung dịch HNO3 loãng tác dụng với kim loại mạnh (như: Al, Mg, Zn,...) thì N bị khử xuống mức càng sâu → (N2, N2O, NH4NO3).
Ví dụ: HNO3 tác dụng với kim loại
• HNO3 + Cu
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O
• HNO3 + Fe
Fe + 4HNO3 (loãng) → Fe(NO3)3 + NO↑ + 2H2O
• HNO3 + Na
8Na + 10HNO3 → 8NaNO3 + NH4NO3 + 3H2O
Lưu ý: Nếu cho Fe hoặc hỗn hợp Fe và Cu tác dụng với dung dịch HNO3 mà sau phản ứng còn dư kim loại → trong dung dịch Fe thu được chỉ ở dạng muối Fe2+.
b) Tác dụng với phi kim → NO2 + H2O + oxit của phi kim.
• HNO3 + C
C + 4HNO3 → CO2 + 4NO2 + 2H2O
• HNO3 + S
S + 4HNO3 → SO2 + 4NO2 + 2H2O
• HNO3 + P
P + 5HNO3 → H3PO4 + 5NO2 + H2O
c) Axit Nitric tác dụng với các chất khử khác (oxit bazơ, bazơ và muối trong đó kim loại chưa có hóa trị cao nhất).
4HNO3 + FeO → Fe(NO3)3 + NO2↑ + 2H2O
4HNO3 + FeCO3 → Fe(NO3)3 + NO2↑ + 2H2O + CO2↑
> Lưu ý:
- Khí N2O là khí gây cười, khí vui
- N2 không duy trì sự sống, sự cháy
- Khí NO2 có màu nâu đỏ
- NH4NO3 không sinh ra ở dạng khí, khi cho kiềm vào kim loại thấy có mùi khai
- HNO3 đặc nguội thụ động (không phản ứng) với Al, Fe, Cr.
III. Bài tập về Axit nitric
* Bài 1 trang 45 SGK Hóa 11: Viết công thức electron và công thức cấu tạo của axit nitric. Cho biết nguyên tố nitơ có hoá trị và số oxi hoá bằng bao nhiêu?
>> Giải Bài 1 trang 45 SGK Hóa 11
* Bài 2 trang 45 sgk hoá 11: Lập các phương trình hoá học
a) Ag + HNO3, đặc → NO2↑ + ? + ?
b) Ag + HNO3, loãng → NO↑ + ? + ?
c) Al + HNO3 → N2O↑ + ? + ?
d) Zn + HNO3 → NH4NO3↑ + ? + ?
e) FeO + HNO3 → NO↑ + Fe(NO3)3 + ?
f) Fe3O4 + HNO3 → NO↑ + Fe(NO3)3 + ?
>> Giải Bài 2 trang 45 SGK Hóa 11
* Bài 3 trang 45 SGK Hóa 11: Hãy chỉ ra những tính chất hoá học chung và khác biệt giữa axit nitric và axit sunfuric. Viết các phương trình hoá học để minh hoạ?
>> Giải Bài 3 trang 45 SGK Hóa 11
* Bài 4 trang 45 SGK Hóa 11: a) Trong các phương trình hoá học của phản ứng nhiệt phân sắt (III) nitrat, tổng các hệ số bằng bao nhiêu?
A. 5 B. 7 C. 9 D. 21
b) Trong phương trình hoá học của phản ứng nhiệt phân thuỷ ngân (II) nitrat, tổng các hệ số bằng bao nhiêu?
A. 5 B. 7 C. 9 D. 21
>> Giải Bài 4 trang 45 SGK Hóa 11
* Bài 5 trang 45 sgk hoá 11: Viết phương trình hóa học của phản ứng thực hiện dãy chuyển hóa sau:
NO2 → HNO3 → Cu(NO3)2 → Cu(OH)2 → Cu(NO3)2 → CuO → Cu → CuCl2
>> Giải Bài 5 trang 45 SGK Hóa 11
* Bài tập 6 trang 45 sgk hoá 11: Khi hoà tan 30,0g hỗn hợp đồng và đồng (II) oxit trong 1,5 lít dung dịch axit nitric 1,00M (loãng) thấy thoát ra 6,72 lit nitơ monooxit (đktc).
Xác định hàm lượng phần trăm của đồng (II) oxit trong hỗn hợp, nồng độ mol của đồng (II) nitrat và axit nitric trong dung dịch sau phản ứng, biết rằng thể tích các dung dịch không thay đổi.
>> Giải Bài 6 trang 45 SGK Hóa 11
* Bài tập 7 trang 45 sgk hoá 11: Để điều chế được 5,000 tấn axit nitric nồng độ 60,0% cần dùng bao nhiêu tấn amoniac? Biết rằng sự hao hụt amoniac trong quá trình sản xuất là 3,8%.
>> Giải Bài 7 trang 45 SGK Hóa 11
Từ khóa » Tính Chất Hóa Học Cơ Bản Của Axit Nitric Là
-
Axit Nitric (HNO3) Là Gì? Tìm Hiểu Về Tính Chất, Lưu ý Khi Sử Dụng
-
Axit Nitric (HNO3) Là Gì? Tính Chất, ứng Dụng, Lưu ý - Vietchem
-
Tính Chất Của Axit Nitric (HNO3), Muối Nitrat: Tính Chất Hóa Học, Vật Lí ...
-
Tính Chất Hóa Học Của HNO3 - Axit Nitric - VOH
-
Tính Chất Hoá Học Của Axit Nitric HNO3. Ví Dụ Và Bài Tập Hóa 11
-
Các Tính Chất Hoá Học Của HNO3 Là :
-
Axit Nitric (HNO3): Cấu Tạo Phân Tử, Tính Chất, Cách điều Chế Và ứng ...
-
[CHUẨN NHẤT] Tính Chất Hóa Học Của HNO3 - TopLoigiai
-
Axit Nitric - Khái Niệm, Tính Chất Vật Lý, Hóa Học Và ứng Dụng
-
Axit Nitric HNO3 Là Gì? Tính Chất, Công Thức, ứng Dụng Của Axit Nitric
-
Tính Chất Hóa Học Của Axit Nitric
-
AXIT LÀ GÌ? TÍNH CHẤT HÓA HỌC CỦA AXIT VÀ MỘT SỐ ỨNG ...
-
Tính Chất Hóa Học Của HNO3 Là Gì? 8 Lưu ý Khi Sử Dụng - GiaiNgo
-
CẤU TẠO, TÍNH CHẤT VẬT LÍ, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ ...