Tính Chất Hoá Học Của Sắt 2, Sắt 3 Oxit Sắt Từ Và Hợp ... - HayHocHoi
Có thể bạn quan tâm
Bài viết này chúng ta cùng tìm hiểu về tính chất hoá học và tính chất vật lý của các hợp chất của sắt 2 và sắt 3 oxit, oxit sắt từ Fe3O4, làm sao để điều chế các một số hợp chất của sắt.
• xem thêm: Cách giải nhanh một số bài tập về sắt Fe và hỗn hợp của sắt
I. Hợp chất của sắt II - Fe (II)
- Trong các phản ứng hoá học ion Fe2+ dễ nhường 1e để trở thành ion Fe3+
Fe2+ + 1e → Fe3+
- Như vậy tính chất đặc trưng của hợp chất sắt 2 - Fe (II) là tính khử
1. Tính chất hoá học của Sắt (II) oxit - FeO
- Là chất rắn, đen, không tan trong nước.
- Tính chất hoá học:
+ FeO là oxit bazơ:
- FeO tác dụng với axit HCl: Fe + HCl
FeO + 2HCl → FeCl2 + H2↑
- FeO tác dụng với axit H2SO4: Fe + H2SO4
FeO + H2SO4 loãng → FeSO4 + H2O
+ FeO là chất oxi hóa khi tác dụng với các chất khử mạnh: H2, CO, Al → Fe:
- FeO tác dụng với H2: FeO + H2
FeO + H2 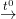 Fe + H2O
Fe + H2O
- FeO tác dụng với CO: FeO + CO
FeO + CO 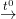 Fe + CO2
Fe + CO2
3FeO + 2Al 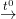 Al2O3 + 3Fe
Al2O3 + 3Fe
+ FeO là chất khử khi tác dụng với các chất có tính oxi hóa mạnh:
- FeO tác dụng với O2: FeO + O2
FeO + O2 → 2Fe2O3
- FeO tác dụng với axit HNO3: FeO + HNO3
3FeO + 10HNO3 loãng → 3Fe(NO3)3 + NO + 5H2O
- Điều chế FeO:
FeCO3 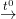 FeO + CO2 (nung trong điều kiện không có không khí)
FeO + CO2 (nung trong điều kiện không có không khí)
Fe(OH)2 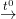 FeO + H2O (nung trong điều kiện không có không khí)
FeO + H2O (nung trong điều kiện không có không khí)

2. Oxit sắt từ Fe3O4 (FeO.Fe2O3)
- Là chất rắn, đen, không tan trong nước và có từ tính.
- Tính chất hoá học:
+ Fe3O4 là oxit bazơ:
- Fe3O4 tác dụng với axit HCl: Fe3O4 + HCl
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
- Fe3O4 tác dụng với axit HCl: Fe3O4 + H2SO4
Fe3O4 + 4H2SO4 loãng → Fe2(SO4)3 + FeSO4 + 4H2O
+ Fe3O4 là chất khử: Fe3O4 + HNO3
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO↑+ 14H2O
+ Fe3O4 là chất oxi hóa:
- Fe3O4 tác dụng với H2: Fe3O4 + H2
Fe3O4 + 4H2 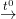 3Fe + 4H2O
3Fe + 4H2O
- Fe3O4 tác dụng với CO: Fe3O4 + CO
Fe3O4 + 4CO 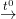 3Fe + 4CO2
3Fe + 4CO2
- Fe3O4 tác dụng với Al: Fe3O4 + Al
3Fe3O4 + 8Al 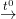 4Al2O3 + 9Fe
4Al2O3 + 9Fe
- Điều chế: thành phần quặng manhetit
3Fe + 2O2 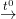 Fe3O4
Fe3O4
3Fe + 4H2O ![small xrightarrow[]{<570^{0}C}](https://hayhochoi.vn/uploads/news/wyswyg/2019_02/giflatexsmallspacexrightarrow570_1550485394.gif) Fe3O4 + 4H2↑
Fe3O4 + 4H2↑
3. Sắt (II) hidroxit Fe(OH)2
- Là chất kết tủa màu trắng xanh.
- Fe(OH)2 là bazơ không tan:
+ Fe(OH)2 Bị nhiệt phân:
Fe(OH)2 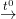 FeO + H2O (nung trong điều kiện không có không khí)
FeO + H2O (nung trong điều kiện không có không khí)
4Fe(OH)2 + O2 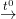 2Fe2O3 + 4H2O (nung trong không khí)
2Fe2O3 + 4H2O (nung trong không khí)
+ Tan trong axit không có tính oxi hóa → muối sắt (II) và nước:
- Fe(OH)2 tác dụng với HCl: Fe(OH)2 + HCl
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
+ Có tính khử (do Fe có mức oxi hóa +2):
- Fe(OH)2 tác dụng với O2: Fe(OH)2 + O2
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
- Fe(OH)2 tác dụng với O2: Fe(OH)2 + HNO3
3Fe(OH)2 + 10HNO3 loãng → 3Fe(NO3)3 + NO + 8H2O
- Điều chế Fe(OH)2 :
Fe2+ + 2OH- → Fe(OH)2 (trong điều kiện không có không khí)
4. Muối sắt II
-Không bền, có tính khử, khi tác dụng với chất oxi hóa tạo thành muối sắt (III).
2FeCl2 + Cl2 → 2FeCl3
3Fe(NO3)2 + 4HNO3 → 3Fe(NO3)3 + NO + 2H2O
2FeSO4 + 2H2SO4 đặc nóng → Fe2(SO4)3 + SO2 + 2H2O
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3 + K2SO4 + Cr2(SO4)3 + 7H2O
* Chú ý: Các muối sắt (II) không tan như FeCO3, FeS, FeS2 bị đốt nóng trong không khí tạo Fe2O3.
2FeCO3 + ½O2 → Fe2O3 + 2CO2
4FeS + 9O2 → 2Fe2O3 + 4SO2
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
II. Hợp chất của sắt III - Fe (III)
- Trong các phản ứng hoá học ion Fe3+ có khả năng nhận 1e đến 3e để trở thành ion Fe2+ hoặc Fe:
Fe3+ + 1e → Fe2+
Fe3+ + 3e → Fe
- Như vậy tính chất đặc trưng của hợp chất sắt 3 - Fe (III) là tính oxi hóa.
1. Tính chất hoá học của Sắt (III) oxit - Fe2O3
- Là chất rắn, nâu đỏ, không tan trong nước.
- Tính chất hoá học:
+ Là oxit bazơ:
- Fe2O3 tác dụng với HCl: Fe2O3 + HCl
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
- Fe2O3 tác dụng với H2SO4 : Fe2O3 + H2SO4
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
- Fe2O3 tác dụng với H2SO4 : Fe2O3 + HNO3
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
+ Là chất oxi hóa:
- Fe2O3 tác dụng với H2 : Fe2O3 + H2
Fe2O3 + 3H2 ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2019_02/giflatexsmallspacexrightarrowt_1550488256.gif) 2Fe + 3H2O
2Fe + 3H2O
- Fe2O3 tác dụng với CO : Fe2O3 + CO
Fe2O3 + 3CO ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2019_02/giflatexsmallspacexrightarrowt_1550488256.gif) 2Fe + 3CO2
2Fe + 3CO2
- Fe2O3 tác dụng với Al : Fe2O3 + Al
Fe2O3 + 2Al ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2019_02/giflatexsmallspacexrightarrowt_1550488256.gif) Al2O3 + 2Fe
Al2O3 + 2Fe
- Điều chế: thành phần của quặng hematit
2Fe(OH)3 ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2019_02/giflatexsmallspacexrightarrowt_1550488256.gif) Fe2O3 + 3H2O
Fe2O3 + 3H2O
2. Sắt (III) hidroxit Fe(OH)3
- Là chất kết tủa màu nâu đỏ.
- Tính chất hoá học:
+ Là bazơ không tan:
+ Bị nhiệt phân:
2Fe(OH)3 → Fe2O3 + 3H2O
+ Tan trong axit → muối sắt (III):
- Fe(OH)3 tác dụng với HCl : Fe(OH)3 + HCl
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
- Fe(OH)3 tác dụng với HNO3 : Fe(OH)3 + HNO3
Fe(OH)3 + 3HNO3 → Fe(NO3)3 + 3H2O
- Điều chế Fe(OH)3:
Fe3+ + 3OH- → Fe(OH)3
3. Muối sắt (III)
- Có tính oxi hóa khi tác dụng với chất khử.
2FeCl3 + Cu → CuCl2 + 2FeCl2
2FeCl3 + 2KI → 2FeCl2 + 2KCl + I2
2FeCl3 + H2S → 2FeCl2 + 2HCl + S
- Các dung dịch muối sắt (III) có môi trường axit:
Fe3+ + 3H2O ↔ Fe(OH)3 + 3H+
- Khi cho muối sắt (III) tác dụng với các kim loại cần lưu ý:
+ Nếu kim loại là Na, Ca, K, Ba + H2O → Kiềm + H2. Kiềm + Fe3+ → Fe(OH)3
+ Nếu kim loại không tan trong nước và đứng trước Fe + Fe3+ → Fe2+ → Fe
+ Nếu kim loại là Cu hoặc Fe + Fe3+ → Fe2+
- Các muối sắt (III) bị thủy phân hoàn toàn trong môi trường kiềm:
2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3 + 6NaCl + 3CO2
III. Bài tập về Sắt (II) oxit, sắt (III) oxit, oxit sắt từ và các hợp chất của sắt.
* Bài 1 trang 145 SGK Hóa 12: Viết phương trình hóa học của các phản ứng trong quá trình chuyển đổi sau:
>> Giải bài 1 trang 145 SGK Hóa 12
* Bài 2 trang 145 sgk hóa 12: Cho sắt tác dụng với dung dịch H2SO4 loãng thu được V lít khí H2 (đktc), dung dịch thu được cho bay hơi thu được tinh thể FeSO4.7H2O có khối lượng là 55,6 gam. Thể tích khí H2(đktc) được giải phóng là:
A. 8,19 lít.
B. 7,33 lít.
C. 4,48 lít.
D. 6,23 lít.
>> Giải bài 2 trang 145 SGK Hóa 12
* Bài 3 trang 145 SGK Hóa 12: Ngâm một đinh sắt nặng 4 gam trong dung dịch CuSO4, sau một thời gian lấy đinh sắt ra, sấy khô, cân nặng 4,2857 gam. Khối lượng sắt tham gia phản ứng là:
A. 1,9990 gam.
B. 1,9999 gam.
C. 0,3999 gam.
D. 2,1000 gam.
>> Giải bài 3 trang 145 SGK Hóa 12
* Bài 4 trang 145 SGK Hóa 12: Hỗn hợp A gồm FeO, Fe3O4, Fe2O3. Trong hỗn hợp A, mỗi oxit đều có 0,5 mol. Khối lượng của hỗn hợp A là:
A. 231 gam.
B. 232 gam.
C. 233 gam.
D. 234 gam.
>> Giải bài 4 trang 145 SGK Hóa 12
* Bài 5 trang 145 SGK Hóa 12: Khử hoàn toàn 16 gam Fe2O3 bằng khí CO ở nhiệt độ cao. Khí đi ra sau phản ứng được dẫn vào dung dịch Ca(OH)2 dư.
Khối lượng kết tủa thu được là:
A. 15 gam.
B. 20 gam.
C. 25 gam.
D. 30 gam.
>> Giải bài 5 trang 145 SGK Hóa 12
Từ khóa » Tính Chất Hoá Học Chung Của Sắt 2
-
Tính Chất Hóa Học Chung Hợp Chất Của Sắt 2 Và Tính Chất Hóa Học ...
-
Tính Chất Hóa Học Chung Của Hợp Chất Sắt (II) Là
-
Tính Chất Hóa Học đặc Trưng Của Hợp Chất SắtII Là Tính - Tự Học 365
-
Hợp Chất Sắt (II) - Học Hóa Online
-
I. Hợp Chất Sắt(II) - Củng Cố Kiến Thức
-
Tính Chất Hóa Học Của Sắt (Fe) | Tính Chất Vật Lí, Nhận Biết, điều Chế ...
-
HỢP CHẤT SẮT(II) - Thiết Kế Và Sử Dụng Hệ Thống Các Thí ... - 123doc
-
Bài 1 Trang 202 SGK Hóa 12 Nâng Cao, Tính Chất Hóa Học Chung Của ...
-
Lý Thuyết Về Hợp Chất Của Sắt | SGK Hóa Lớp 12
-
Giải Bài Tập Hóa Học 12 - Bài 41: Một Số Hợp Chất Của Sắt (Nâng Cao)
-
Tính Chất Hố Học Chung Của Hợp Chất Sắt II: - Tài Liệu Text - 123doc
-
Đề Xuất 7/2022 # Tính Chất Hoá Học Của Sắt 2, Sắt 3 Oxit Sắt Từ ...
-
Tính Chất Hóa Học Của Hợp Chất Sắt 2 | Tấm-cá