Cách Giải Nhanh Bài Tập Este - Gia Sư Tâm Tài Đức
Có thể bạn quan tâm
Mục Lục
- Xác định công thức phân tử và công thức cấu tạo của este
- Phản ứng đốt cháy este
- 20 bài tập trắc nghiệm về phản ứng đốt cháy este ( có đáp án)
- Hiệu suất của phản ứng este hóa, phản ứng thủy phân este và phản ứng xà phòng hóa
- Phản ứng xà phòng hóa của chất béo. Xác định chỉ số chất béo
- Bài tập trắc nghiệm: Phản ứng xà phòng hóa chất béo. Xác định chỉ số chất béo ( có đáp án)
- Phương pháp giải bài tập hỗn hợp este và các hợp chất khác
- Phương pháp giải bài tập thủy phân Este đa chức
- 80 BTTN tổng hợp về este – lipit (Có đáp án)
Xác định công thức phân tử và công thức cấu tạo của este
1. Phương pháp giải:
– Cần nắm vững kiến thức lý thuyết về tính chất hóa học của este.
– CTTQ:
+ este no, đơn chức, mạch hở: CnH2nO2 ( n>=2)
+ Este đơn chức: CxHyO2, y chẵn hay RCOOR’ ( R’ # H )
+ Este 2 chức: R1-OOC-R-COO-R2 ( axit 2 chức R(COOH)2, rượu đơn chức R1OH, R2OH) hoặc R1-COO-R-OOC-R2 ( axit đơn chức R1COOH, R2COOH, rượu 2 chức R(OH)2; R1 và R2 có thể giống hoặc khác nhau.
– Nhận dạng este:
+ Khi đốt cháy hoàn toàn 1 este thu được: nCO2 = nH2O => este no, đơn chức, mạch hở
nCO2 > nH2O => este không no

– Xác định CTPT của este:
+ Xác định KLPT của este: từ Meste => CTPT este
+ Từ phản ứng thủy phân, xác định ancol và axit trong este => CTPT este
– Cần lưu ý:
+ Phản ứng thủy phân este có các trường hợp đặc biệt: khi gốc rượu có C mang nối đôi gắn trực tiếp với nhóm cacboxyl. Khi đó, sản phẩm của phản ứng thủy phân không phải ancol mà sẽ là andehit ( nếu C mang nối đôi là bậc 1) hoặc xeton ( nếu C mang nối đôi là bậc 2)
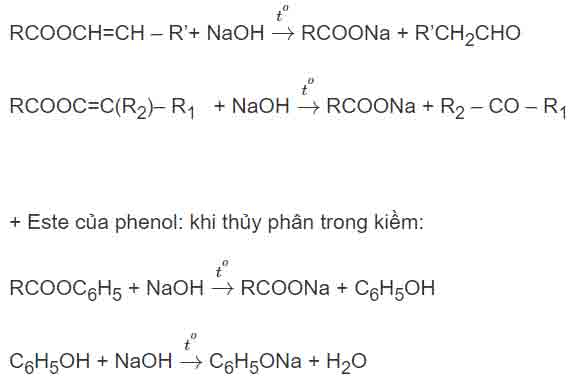
– Kết hợp với các kiến thức đã học để xác định cấu tạo chính xác của este:
+ este làm mất màu nước Brom => este có nối đôi
+ este đơn chức có phản ứng tráng bạc => este của axit fomic. HCOOR
…
II. Bài tập ví dụ:
Ví dụ 1:
Hợp chất hữu cơ đơn chức, k phân nhánh X có chứa các nguyên tố C, H, O. X tác dụng được với NaOH và tham gia phản ứng tráng bạc. 0,1 mol X tác dụng vừa đủ với NaOH, sau phản ứng thu được 6g một ancol. Xác định CTCT của X.
Lời giải
Theo đề bài: X + NaOH => X là axit cacboxylic hoặc este
Mặt khác: X tham gia phản ứng tráng bạc => X là este của axit fomic
CTTQ của X: HCOOR
HCOOR + NaOH—- HCOONa + ROH
0,1 0,1
MROH = 6/0,1 = 60 => R = 43: C3H7
X không phân nhánh nên X có CTCT là: HCOOCH2CH2CH3
Ví dụ 2:
Đốt cháy m (g) este mạch hở X tạo thành 0,4 mol CO2 và 5,4g H2O.. 1 mol X làm mất màu dung dịch chứa 160g Br2. 1 mol X thủy phân vừa đủ với 1 mol kiềm tạo ra một sản phẩm thủy phân có thể tham gia phản ứng tráng bạc. Xác định CTPT, CTCT X.
Lời giải:
1 mol X làm mất màu 1 mol Br2 => trong X có chứa 1 nối đôi
1 mol X thủy phân vừa đủ với 1 mol NaOH => X đơn chức
=> Đặt CTPT của este X là: CnH2n-2O2
Có: nC:nH = n : (2n-2) = 0,4 : 0,6 => n = 4
=>CTPT của X: C4H6O2
X thủy phân cho sản phẩm tham gia phản ứng tráng bạc
TH1: X là este của axit fomic:=> X có CTCT: HCOOCH=CH-CH3 hoặc HCOOC(CH3)=CH2
TH2: X thủy phân ra andehit: => X có CTCT: CH3COOCH=CH2
=> Có 3 CTCT của X phù hợp đề bài.HCOOCH=CH-CH3; HCOOC(CH3)=CH2; CH3COOCH=CH2
Ví dụ 3:
Este mạch thẳng A có CTPT C7H12O4 chỉ chứa 1 loại nhóm chức. Để thủy phân 16g A cần vừa đủ 200g dung dịch NaOH 4%, thu được 1 ancol B và 17,8g hỗn hợp 2 muối. Xác định CTCT của A.
Lời giải:
nNaOH = 0,2 mol
nA= 0,1 mol
=> A là este 2 chức
– Lại có: A + NaOH => hỗn hợp 2 muối => A có dạng: R1-COO-R-OOCR2
R1-COO-R-OOC-R2 + 2NaOH — R1COONa + R2COONa + R(OH)2
0,1 0,1 0,1 0,1
M muối = 0,1. ( R1 + R2 + 134) = 17,8 g
=> R1 + R2 = 44
R1 = 1: HCOONa thì R2= 43: C3H7COONa
R2=15: CH3COONa thì R2 = 29: C2H5COONa
Mặt khác: BTKL => mR(OH)2 = (16+ 8 -17,8).0,1 = 6,2
=> R(OH)2 = 62
=> R= 28 => C2H4(OH)2
X k phân nhánh nên có thể có 2 CTCT phù hợp là:
HCOO-CH2-CH2-OOC-CH2-CH2-CH3
CH3COOCH2-CH2-OOCCH2CH3
Ví dụ 4:
Thủy phân hoàn toàn 0,1 mol este đơn chức X trong NaOH dư, thu được 19,8 g hỗn hợp gồm 2 muối. Biết X không phản ứng với Brom. Xác định CTPT và CTCT của X.
Lời giải:
0,1 mol este đơn chức X + 0,3 mol NaOH thu được hỗn hợp 2 muối => X là este 2 chức dạng R1-OOC-R-COOR2 hoặc X là este của phenol.
Trường hợp 1: X là este 2 chức R1-OOC-R-COOR2
Tương tự VD3: tính được R1 + R2 = 64, X k phản ứng với Brom nên R1 và R2 đều no, k chọn được cặp giá trị thỏa mãn.
Trường hợp 2: X là este của phenol => X có dạng: RCOOC6H5
RCOOC6H5 + 2NaOH -à RCOONa + C6H5ONa + H2O
=>M(muối) = 0,1.(R + 67) + 0,1.116 = 19,8
=> R = 15: CH3
=>X là: CH3COOC6H5
III. Bài tập về nhà:
Bài 1: Thủy phân hoàn toàn 11,44g hỗn hợp 2 este đơn chức là đồng phân của nhau bằng dung dịch NaOH, thu được 11,08g hỗn hợp muối và 5,56g hỗn hợp 2 ancol. Xác định CTCT của 2 este.
(Đáp án: HCOOC3H7 và C2H5COOCH3 hoặc C2H5COOCH3 và CH3COOC2H5)
Bài 2: X chứa C, H, O mạch thẳng. Lấy 0,1 mol X tác dụng vừa đủ với 0,2 mol NaOH thu được 0,1 mol muối và 0,2 mol một ancol có tỉ khối hơi so với O2 là 1. Xác định CTCT của X
( Đáp án: H3C-OOC-CH2-CH2-COO-CH3)
Bài 3: Thủy phân hoàn toàn 2,22g hỗn hợp 2 este đồng phân X và Y cần dùng 30 ml dung dịch NaOH 1M. Đốt cháy hoàn toàn hỗn hợp này thu được CO2 và H2O có số mol bằng nhau. Xác định X và Y
( Đáp án: HCOOC2H5, CH3COOCH3)
Bài 4: Chất A có CTPT C6H10O4 tác dụng với NaOH theo tỉ lệ số mol 1:2. Sản phẩm tạo thành có 3 chất hữu cơ B, C, D có số mol bằng nhau. B tác dụng được với Cu(OH)2 và C tạo thành CH4 bằng 1 phản ứng. Xác định CTCT của A.
(Đáp án: CH3-COO-CH(CH3)-CH2-OOCH )
⚗️ GIA SƯ HÓA
Phản ứng đốt cháy este
I. Kiến thức cần nắm vững:
1. Phản ứng đốt cháy 1este:
a. Este no, đơn chức, mạch hở:
– CTTQ: CnH2nO2, n≥2

e. Este bất kì:
– CTTQ: CxHyOz. x, y, z nguyên dương, x>=2, z>=2
– Phản ứng cháy: CxHyOz + O2 —-> xCO2 + y/2H2O
– Áp dụng các định luật bảo toàn khối lượng, định luật bảo toàn nguyên tố… để giải bài toán.
2. Bài toán đốt cháy hỗn hợp các este:
a. Bài toán đốt cháy 2 este đồng phân:
– các este đồng phân => có cùng CTPT, cùng KLPT.
b. Bài toán đốt cháy 2 este tạo thành từ cùng 1 axit, 2 ancol đồng đẳng hoặc cùng 1 ancol, 2 axit đồng đẳng:
– Các este này sẽ có cùng dạng CTTQ => Đặt CTPT trung bình để viết phương trình phản ứng, đưa về bài toán 1 este.
– số liên kết pi trong phân tử: k =( 2nC – nH +2)/2
c. Bài toán đốt cháy hỗn hợp nhiều este có cùng CTTQ:
– Đặt CTPT trung bình
– Áp dụng các định luật bảo toàn để giải bài toán.
II. Bài tập minh họa:
Ví dụ 1: Đốt cháy 6g este Y ta thu được 4,48 l CO2 (đktc) và 3,6g H2O. Tìm CTCT của Y.
Lời giải:
nCO2 = 0,2 mol
nH2O = 0,2 mol
=> nCO2 = nH2O => este Y no, đơn chức, mạch hở
Đặt CTTQ của Y là CnH2nO2
Có: CnH2nO2 + O2 ———–> nCO2 + nH2O14n+32 n mol
6 0,2 mol
=> (14n +32).0,2 = 6n
=> n = 2
=> CTPT của Y: C2H4O2
=> CTCT của Y: HCOOCH3
Ví dụ 2: Cho 14,8g một hỗn hợp gồm 2 este đồng phân của nhau bay hơi ở điều kiện thích hợp. Kết quả thu được một thể tích hơi đúng bằng thể tích của 6,4g oxi trong cùng điều kiện như trên. Khi đốt cháy hoàn toàn hỗn hợp hai este trên, thu được sản phẩm phản ứng là CO2 và H2O , tỉ lệ thể tích khí CO2 và hơi H2O là 1:1. Xác định CTCT của 2 este.
Lời giải:
Theo bài ra: nCO2 : nH2O = 1:1 => 2 este là no, đơn chức, mạch hở
Đặt CTTQ của 2 este đồng phân là CnH2nO2, n>=2
Có: thể tích hơi của 14,8g este bằng thể tích hơi của 6,4g O2
=> neste = nO2 = 0,2 mol
=> Meste = 74
=> 14n+32 =74 => n=3=>CTPT: C3H6O2
CTCT của 2 este là CH3COOCH3 và HCOOC2H5.
Ví dụ 3:
Đốt cháy hoàn toàn một lượng hỗn hợp hai este no, đơn chức cần 3,976 lit O2 (đktc) thu được 6,38g CO2. Cho lượng este này tác dụng vừa đủ với KOH thu được hỗn hợp 2 ancol kế tiếp và 3,92g muối của một axit hữu cơ. Tìm CTCT 2 este đó.
Lời giải:
nO2 = 0,1775 mol
nCO2 = 0,145 mol
2 este + KOH => hỗn hợp 2 ancol kế tiếp và muối của 1 axit hữu cơ => Bài toán 2 este tạo bởi cùng 1 axit hữu cơ và 2 ancol là đồng đẳng liên tiếp.
Đặt CTPT trung bình của 2 este là C¯nH2¯nO2Cn¯H2n¯O2
Phản ứng cháy:

III. Luyện tập:
Bài 1: Đốt cháy hoàn toàn 1,48g một hợp chất hữu cơ X thu được 2,64g khí cacbonic và 1,08 g nước. Biết X là este hữu cơ đơn chức. Este X tác dụng với dung dịch NaOH cho một muối có khối lượng phân tử bằng 34/37 khối lượng phân tử của este. Xác định CTCT của X.
Bài 2: Cho hỗn hơp Y gồm 2 este no, đơn chức, mạch hở là đồng phân của nhau. Cho m gam hỗn hợp X tác dụng vừa đủ với 100ml dung dịch NaOH 0,5M thu được muối của 1 axit hữu cơ và hỗn hợp 2 ancol. Mặt khác, để đốt cháy hoàn toàn m gam hỗn hợp X cần 5,6l khí Oxi, thu được 4,48l khí CO2. thể tích các khí đều đo ở đktc. Xác định CTCT của 2 este.
Bài 3: Đốt cháy hoàn toàn 1,7g este X, đơn chức cần 2,52 lit O2 (đktc) thu được CO2 và H2O có tỉ lệ số mol là 1:2. Biết rằng 0,01 mol X tác dụng vừa đủ với 0,02 mol NaOH, X không có phản ứng tráng gương và KLPT của X < 140. Xác định CTCT của X.
20 bài tập trắc nghiệm về phản ứng đốt cháy este ( có đáp án)
Hiệu suất của phản ứng este hóa, phản ứng thủy phân este và phản ứng xà phòng hóa
I. Phương pháp giải:
– Phản ứng este hóa là phản ứng giữa axit cacboxylic và ancol trong điều kiện nhiệt độ, có H2SO4 đặc làm xúc tác. Trong điều kiện đó, đồng thời xảy ra phản ứng thủy phân este trong môi trường axit, tạo ra axit và ancol ban đầu. Phản ứng este hóa và phản ứng thủy phân este trong axit là phản ứng thuận nghịch, hiệu suất phản ứng H <100%.
– Phản ứng thủy phân este trong môi trường kiềm – phản ứng xà phòng hóa – là phản ứng 1 chiều, nhưng phản ứng có thể xảy ra hoàn toàn hoặc không hoàn toàn. Hiệu suất phản ứng H ≤≤1. H = 1: phản ứng xảy ra hoàn toàn.
– Xét phản ứng: A ⇌ B
Hiệu suất phản ứng tính theo sản phẩm tạo thành B là: HB% =−1
Trong đó:
msptt: Lượng sản phẩm trên lí thuyết: là lượng sản phẩm tính được từ tỉ lệ số mol trên phương trình.
msplt: Lượng sản phẩm trên thực tế: là lượng sản phẩm cho trong đề bài. Lượng chất có thể tính theo khối lượng hay số mol
Nếu tính hiệu suất theo chất tham gia A thì:
HA%=−1
Trong đó:
mctglt: Lượng chất tham gia trên lí thuyết là lượng chất tính từ phương trình.
mcthtt: Lượng chất tham gia thực tế là lượng chất cho trong đề bài.
– Khi đề bài cho chất tham gia ban đầu có chứa bao nhiêu % tạp chất =>lượng chất tham gia thực tế = lượng cho trong đề. (100 – %tạp chất)
– Đề bài cho sự hao hụt trong quá trình phản ứng/sản xuất thì lượng chất thực tế phản ứng = lượng chất trong đề bài . (100% – % hao hụt)
– Khi đề bài cho quá trình gồm n giai đoạn, mỗi giai đoạn có hiệu suất H1, H2,…,Hn… thì hiệu suất của toàn quá trình là H = H1.H2….Hn
II. Bài tập minh họa
Ví dụ 1:
Thực hiện phản ứng este hóa 9,2g glixerol với 60g axit axetic. Giả sử chỉ thu được glixerol triaxetat có khối lượng 17,44g. Tính hiệu suất của phản ứng este hóa:
Lời giải:
nglixerol = 0,1 mol
naxit axetic = 1 mol
C3H5(OH)3 + 3CH3COOH ⇌ C3H5(OOCCH3)3 + 3H2O
0,1 0,3 0,1
Từ PT: meste= 0,1. 218 = 21,8g
Thực tế: meste=17,44g
Hiệu suất: H% = 17,4421,8.10017,4421,8.100=80%
Ví dụ 2:
Thực hiện phản ứng este hóa m gam CH3COOH bằng 1 lượng vừa đủ C2H5OH thu được 0,02 mol este. Hiệu suất phản ứng H = 60%. Giá trị của m?
Lời giải:
CH3COOH + C2H5OH ⇌⇌ CH3COOC2H5 + H2O
1 mol →→ 1 mol
0,02 mol ←← 0,02 mol
Theo lí thuyết: khối lượng CH3COOH cần dùng là: 60.0,02=1,2 g
Hiệu suất H= 60% => thực tế khối lượng axit đã dùng: m = 1,2.100/60=2 g
Ví dụ 3:
Từ 1 kg đất đèn( trong đó có 96% canxi cacbua) điều chế ra axit axetic, hiệu suất toàn quá trình điều chế axit đạt 80%. Toàn bộ lượng axit thu được cho tham gia phản ứng este hóa với lượng dư ancol etylic. Hiệu suất phản ứng este hóa là 90%. Tính khối lượng este etyl axetat thu được.
Lời giải:
CaC2 —> C2H2 —->C2H5COOH ( H= 80%) —–> CH3COOC2H5(H=90%)
64 kg —-> 88 kg
0,96 kg —–> 0,96.88/64 = 1,32 kg
Theo lí thuyết: thu được 1,32 kg este
Hiệu suất các giai đoạn là 80% và 90% => Khối lượng este thực tế thu được: meste =1,32.80.90/100.100= 0,9504 kg
III. Luyện tập:
Câu 1 (ĐH khối A 2007): Hỗn hợp X gồm axit HCOOH và axit CH3COOH (tỉ lệ mol 1:1). Lấy 5,3 gam hỗn hợp X tác dụng với 5,75 gam C2H5OH ( có xúc tác H2SO4 đặc) thu được m gam hỗn hợp este ( hiệu suất của các phản ứng este hoá đều bằng 80%). Giá trị của m là:
A.10,12 B.6,48 C.8,10 D.16,20
Câu 2: (CĐ khối A-2008): Đun nóng 6,0 gam CH3COOH với 6,0 gam C2H5OH ( có H2SO4 làm xúc tác, hiệu suất phản ứng este hoá bằng 50%). Khối lượng este tạo thành là:
A.6,0 gam B.4,4 gam C.8,8 gam D.5,2 gam
Câu 3:Đun 12 gam axit axetic với 1 lượng dư ancol etylic ( có H2SO4 đặc làm xúc tác). Đến khi phản ứng dừng lại thu được 11 gam este. Hiệu suất của phản ứng este hoá là bao nhiêu?
A.70% B.75% C.62,5% D.50%
Câu 4:Khi đun nóng 25,8 gam hỗn hợp ancol etylic và axit axetic có H2SO4 đặc làm xúc tác thu được 14,08 gam este. Nếu đốt cháy hoàn toàn lượng hỗn hợp đó thu được 23,4 ml H2O. Tìm thành phần trăm mỗi chất trong hỗn hợp đầu và hiệu suất của phản ứng este hoá.
A.53,5% C2H5OH; 46,5% CH3COOH và hiệu suất 80%
B.55,3% C2H5OH; 44,7% CH3COOH và hiệu suất 80%
C.60,0% C2H5OH; 40,0% CH3COOH và hiệu suất 75%
D.45,0% C2H5OH; 55,0% CH3COOH và hiệu suất 60%
Câu 5:Biết rằng phản ứng este hoá CH3COOH + C2H5OH CH3COOC2H5 + H2O
Có hằng số cân bằng K = 4, tính % Ancol etylic bị este hoá nếu bắt đầu với [C2H5OH] = 1 M, [CH3COOH] = 2 M.
A.80% B.68% C.75% D.84,5%
Câu 6: Tính khối lượng este metyl metacrylat thu được khi đun nóng 215 gam axit metacrylic với 100 gam ancol metylic. Giả thiết phản ứng este hoá đạt hiệu suất 60%.
A.125 gam B.175 gam C.150 gam D.200 gam
Câu 7: Đun nóng axit axetic với ancol isoamylic (CH3)2CH-CH2-CH2OH có H2SO4 đặc làm xúc tác thu được isoamyl axetat (dầu chuối). Tính lượng dầu chuối thu được từ 132,35g axit axetic đun nóng với 200g ancol isoamylic. Biết hiệu suất phản ứng đạt 68%
A. 97,5g B. 195g C. 292,5g D. 159g
Câu 8: Chia a g axit axetic làm 2 phần bằng nhau. Phần 1 được trung hòa vừa đủ bằng 0,5 lít dd NaOH 0,4M; phần 2 thực hiện phản ứng este hóa với ancol etylic thu được m g este. Giả sử hiệu suất phản ứng đạt 100%, giá trị của m là
A. 16,7. B. 17,6. C. 18,6. D. 16,8.
Câu 9: Đun nóng axit axetic với ancol isoamylic (CH3)2CHCH2CH2OH có H2SO4 đặc xúc tác thu được isoamyl axetat (dầu chuối). Tính lượng dầu chuối thu được từ 132,35 g axit axetic đun nóng với 200 g ancol isoamylic? Biết hiệu suất phản ứng đạt 68%.
A. 292,5 g B. 421,7 g C. 195,0 g D. 226,0 g
Đáp án:
1B 2B 3C 4A 5D 6C 7B 8B 9C
Phản ứng xà phòng hóa của chất béo. Xác định chỉ số chất béo
1. Kiến thức liên quan:
a. Phản ứng xà phòng hóa chất béo:
– là phản ứng của chất béo với dung dịch kiềm NaOH/KOH, tạo grixerol và hỗn hợp các muối Na/K. Hỗn hợp các muối này chính là xà phòng.

– Là phản ứng không thuận nghịch.
b. Các chỉ số chất béo:
– Chỉ số axit: là số miligam KOH cần để trung hòa axit béo tự do có trong 1g chất béo.
– Chỉ số xà phòng hóa: là số miligam KOH cần để xà phòng hóa glixerit và trung hòa axit béo tự do trong 1g chất béo.
– Chỉ số este: là số miligam KOH cần để xà phòng hóa glixerit của 1 g chất béo, là hiệu số giữa chỉ số xà phòng hóa và chỉ số axit.
– Chỉ số I2: là số miligam I2 có thể cộng với 100g chất béo không no.
2. Ví dụ minh họa:
Ví dụ 1:
Khi xà phòng hóa 2,52g chất béo A cần 90ml dung dịch KOH 0,1M. Mặt khác, xà phòng hóa hoàn toàn 5,04g chất béo A thu được 0,53g glixerol. Tìm chỉ số axit và chỉ số xà phòng hóa.
Lời giải:
Có: mKOH = 0,09.0,1.56.1000= 504 mg
=> Chỉ số xà phòng hóa: = 200 mg.
Phản ứng xà phòng hóa:
(RCOO)3C3H5 + 3KOH —> C3H5(OH)3 + 3RCOOK
nKOH= 3nglixerol = 3.0,53/92=> mKOH = nKOH.56

=> chỉ số este của mẫu chất béo = chỉ số xà phòng hóa – chỉ số axit
=> chỉ số axit = chỉ số xà phòng hóa – chỉ số este = 200 – 192 = 8 mg
Ví dụ 2:
Để trung hòa lượng axit tự do có trong 14g một mẫu chất béo, cần 15ml dung dịch KOH 0,1M. Tính chỉ số axit của mẫu chất béo.
Lời giải:
mKOH= 15.0,1.56= 84 mg
=> số miligam KOH cần dùng để trung hòa lượng axit tự do trong 1g mẫu chất béo là: 84/14 = 6 mg
=> chỉ số axit của mẫu chất béo là: 6
Ví dụ 3:
Để trung hòa 10g một chất béo có chỉ số axit là 5,6 cần dùng bao nhiêu gam NaOH?
Lời giải:
Mẫu chất béo có chỉ số axit là 5,6 => Ta có:
Cứ trung hòa 1g chất béo cần 5,6 mgKOH=> tương ứng với 4mg NaOH
Vậy: trung hòa 10g chất béo ———————————– 40mg = 0,04g NaOH
=> Cần 0,04g NaOH.
Ví dụ 4:
xà phòng hóa 1kg chất béo có chỉ số axit là 2,8 cần dùng 350 ml dung dịch KOH 0,1M. Khối lượng glixerol thu được là bao nhiêu?
Lời giải:
cách 1:
nKOH = 0,35.1 = 0,35 mol => mKOH = 0,35.56.1000=19600 mg
=> chỉ số xà phòng hóa của mẫu chất béo là: = 19,6 mg
=> chỉ số este = chỉ số xà phòng hóa – chỉ số axit = 19,6 – 2,8 = 16,8mg
(RCOO)3C3H5 + 3KOH — C3H5(OH)3 + 3RCOOK (1)
1g 16,8mg
1kg 16,8g

3. Bài tập tự giải:
Bài 1:Để xà phòng hóa 10kg chất béo có chỉ số axit bằng 7, người ta cho chất béo đó tác dụng với dung dịch chứa 1,42kg NaOH. Sau phản ứng hỗn hợp được trung hòa vừa đủ bởi 500ml dung dịch HCl 1 M.
a. Tính khối lượng glixerol và khối lượng xà phòng nguyên chất thu được.
b. Tìm khối lượng phân tử trung bình của các axit béo, biết rằng axit béo tự do cũng chính là axit đã tạo ra chất béo.
Bài 2: Xà phòng hoá 1 kg chất béo có chỉ số axit bằng 7, chỉ số xà phòng hoá 200.Khối lượng glixerol thu được là bao nhiêu?
Bài 3: Một loại mỡ chứa 70% triolein và 30% tristearin về khối lượng. Tính khối lượng xà phòng thu được khi xà phòng hoá hoàn toàn 100kg chất mỡ đó bằng NaOH.
Bài 4: Một loại mỡ chứa 40% triolein, 20% tripanmitin, 40% tristearin. Xà phòng hoá hoàn toàn m gam mỡ trên bằng NaOH thu được 138 gam glixerol. Giá trị của m?
Bài 5: Để xà phòng hoá 35kg triolein cần 4,939 kg NaOH thu được 36,207 kg xà phòng. Xác định chỉ số axit của mẫu chất béo trên.
Bài tập trắc nghiệm: Phản ứng xà phòng hóa chất béo. Xác định chỉ số chất béo ( có đáp án)
Phương pháp giải bài tập hỗn hợp este và các hợp chất khác
Phương pháp giải bài tập thủy phân Este đa chức
80 BTTN tổng hợp về este – lipit (Có đáp án)
Xem thêm
Gia sư hóa học
Phương pháp bảo toàn điện tích trong hóa học hay, chi tiết, có lời giải
Cách giải nhanh bài tập Este
Cách giải nhanh bài toán CO2 tác dụng với kiềm
Từ khóa » Este Bậc 2
-
Công Thức Cấu Tạo Của Este (Chi Tiết - Có Ví Dụ Minh Họa)
-
Tổng Hợp Lý Thuyết Este Và Bài Tập Vận Dụng - Kiến Guru
-
Bài Tập Este Cơ Bản Phân Dạng Và Đáp Án Chi Tiết - Kiengurubrand
-
Cách Tìm Công Thức Phân Tử Của Este Dựa Vào Phản ứng Xà Phòng ...
-
Cách Tìm Công Thức Este - Thả Rông
-
Xác định Công Thức Phân Tử Và Công Thức Cấu Tạo Của Este
-
Este Là Gì? Lý Thuyết đầy đủ Về Este - Tự Học 365
-
Tên Gọi Của Este Có Công Thức Phân Tử C4H8O2 Khi Thủy Phân Cho ...
-
Tên Gọi Của Este Có Công Thức Phân Tử C4H8O2khi Thủy Phân Cho ...
-
Tính Chất Hoá Học Của Este, Bài Tập Về Este - Hoá 12 Bài 1 - Hayhochoi
-
Các Phương Trình Của Este – Tính Chất Hoá Học ...
-
Tên Gọi Của Este Có Công Thức Phân Tử C4H8O2 Khi Thủy ...