Este Là Gì? Lý Thuyết đầy đủ Về Este - Tự Học 365
Có thể bạn quan tâm
Este là gì? Lý thuyết đầy đủ về Este
1) Khái niệm, danh pháp của ESTE
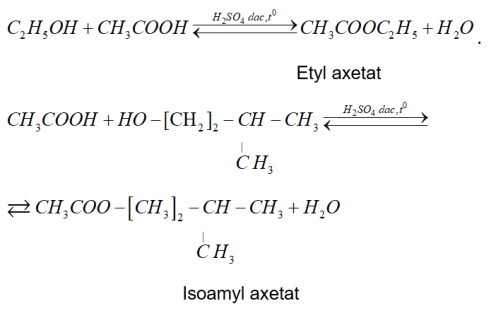
•Phương trình tổng quát
![]()
⇒ Khi thay thế nhóm OH ở nhóm cacboxyl của axit cacboxylic bằng nhóm OR’ thì được este.
• CTCT của este đơn chức:
RCOOR’
R: gốc hiđrocacbon của axit hoặc H.
R’: gốc hiđrocacbon của ancol (R # H)
• CTCT chung của este no đơn chức:
- CnH2n+1COOCmH2m+1 (n ≥ 0, m ≥ 1)
- CxH2xO2 (x ≥ 2)
• Tên gọi:
Tên gốc hiđrocacbon của ancol + tên gốc axit.
• Tên gốc axit:
Xuất phát từ tên của axit tương ứng, thay đuôi ic→at.
• Thí dụ:
CH3COOCH2CH2CH3: propyl axetat
HCOOCH3: metyl fomat
2) Đồng phân của ESTE
• Đồng phân Axit
• Đồng phân este
• Đồng tạp chức
• Đồng phân mạch vòng
• Lưu ý: CnH2nO2 có thể có các đồng phân sau
• Đồng phân cấu tạo:
+ Đồng phân este no đơn chức
+ Đồng phân axit no đơn chức
+ Đồng phân rượu không no có một nối đôi hai chức
+ Đồng phân ete không no có một nối đôi hai chức
+ Đồng phân mạch vòng (rượu hoặc ete)
+ Đồng phân các hợp chất tạp chức:
| Chứa 1 chức rượu 1 chức anđehit Chứa 1 chức rượu 1 chức xeton Chứa 1 chức ete 1 chức anđehit Chứa 1 chức ete 1 chức xeton Một rượu không no và một ete no Một ete không no và một rượu no |
• Đồng phân cis – tran (Đồng phân rượu không no có một nối đôi hai chức - Đồng phân ete không no có một nối đôi hai chức - Một rượu không no và một ete no - Một ete không no và một rượu no)
• Số đồng phân este no đơn chức =2n-2 (1< n < 5)
• Công thức tính số triglixerit tạo bởi glixerol với n axit carboxylic béo =$\frac{{{n}^{2}}}{2\left( n+1 \right)}$
3) Tính chất vật lý của ESTE
• Các este là chất lỏng hoặc chất rắn trong điều kiện thường
• Các este hầu như không tan trong nước.
• Có nhiệt độ sôi thấp hơn hẳn so với các axit hoặc các ancol có cùng khối lượng mol phân tử hoặc có cùng số nguyên tử cacbon. do giữa các phân tử este không tạo được liên kết hiđro với nhau và liên kết hiđro giữa các phân tử este với nước rất kém.
• Thí dụ
| CH3CH2CH2COOH: (M = 88) CH3[CH2]3CH2OH: (M = 88), CH3COOC2H5: (M = 88), |
• Các este thường có mùi đặc trưng
| Iso amyl axetat có mùi chuối chín Etyl butirat và etyl propionat có mùi dứa Geranyl axetat có mùi hoa hồng… |
4) Tính chất hóa học của ESTE
a) Thủy phân trong môi trường kiềm(Phản ứng xà phòng hóa)
R-COO-R’ + Na-OH $\xrightarrow{{{t}^{0}}}$R –COONa + R’OH
b) Thủy phân trong môi trường axit
R-COO-R’ + H-OH $\underset{{}}{\overset{{{H}^{+}},{{t}^{0}}}{\longleftrightarrow}}$ R –COOH + R’OH
· Nêu Phương pháp để phản ứng chuyển dịch theo chiều thuận
c) Phản ứng khử của ESTE
R-COO-R’ $\xrightarrow{LiAl{{H}_{4}},{{t}^{0}}}$ R –CH2OH + R’OH
d) Một số chú ý quan trọng
Este + NaOH $\xrightarrow{{{t}^{0}}}$ 1Muối + 1 anđehit
⇒ Este này khi Phản ứng với dd NaOH tạo ra rượu có nhóm -OH liên kết trên cacbon mang nối đôi bậc 1 không bền đồng phân hóa tạo ra anđehit.
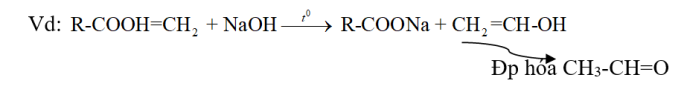
Este + NaOH ![]() 1 Muối + 1 xeton
1 Muối + 1 xeton
⇒ Este này khi Phản ứng tạo rượu có nhóm -OH liên kết trên cacbon mang nối đôi bậc 2 không bền đồng phân hóa tạo xeton.
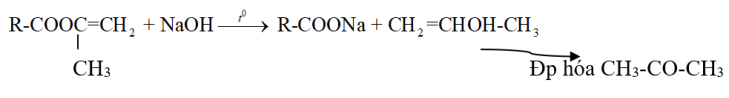
Este + NaOH $\xrightarrow{{{t}^{0}}}$ 2 Muối + H2O
⇒ Este này có gốc rượu là phenol hoặc đồng đẳng phenol..
RCOO![]() + 2NaOH $\xrightarrow{{{t}^{0}}}$ RCOONa + C6H5ONa + H2O
+ 2NaOH $\xrightarrow{{{t}^{0}}}$ RCOONa + C6H5ONa + H2O
Este + AgNO3/ NH3 → Phản ứng tráng gương
HCOOR + 2AgNO3 + 3NH3 + H2O → ROCOONH4 + 2Ag + 2NH4NO3
Este no đơn chức khi cháy thu được ${{n}_{C{{O}_{2}}}}={{n}_{{{H}_{2}}O}}$
e) Phản ứng cháy của ESTE
${{C}_{n}}{{H}_{2n}}{{O}_{2}}+\frac{3n-2}{2}{{O}_{2}}\xrightarrow{{{t}^{0}}}nC{{O}_{2}}+n{{H}_{2}}O$
5) Điều chế
a) Phản ứng của ancol với axit cacboxylic
RCOOH + R’OH $\underset{{}}{\overset{{{H}^{+}},{{t}^{0}}}{\longleftrightarrow}}$ RCOOR’ + H2O
b) Phản ứng của ancol với anhiđrit axit hoặc anhiđrit clorua
– Ưu điểm: Phản ứng xảy ra nhanh hơn và một chiều
(CH3CO)2O + C2H5OH → CH3COOC2H5 + CH3COOH
CH3COCl + C2H5OH → CH3COOC2H5 + HCl
c) Điều chế các este của phenol
Từ phản ứng của phenol với anhiđrit axit hoặc anhiđrit clorua(vì phenol không tác dụng với axit cacboxylic)
(CH3CO)2O + C6H5OH → CH3COOC6H5 + CH3COOH
CH3COCl + C6H5OH → CH3COOC6H5 + HCl
d) Phản ứng cộng vào hiđrocacbon không no của axit cacboxylic
– Anken
CH3COOH + CH=CH $\xrightarrow{xt,{{t}^{0}}}$ CH3COOCH2 – CH3
– Ankin
CH3COOH + CH≡CH $\xrightarrow{xt,{{t}^{0}}}$CH3COOCH=CH2
Từ khóa » Este Bậc 2
-
Công Thức Cấu Tạo Của Este (Chi Tiết - Có Ví Dụ Minh Họa)
-
Tổng Hợp Lý Thuyết Este Và Bài Tập Vận Dụng - Kiến Guru
-
Bài Tập Este Cơ Bản Phân Dạng Và Đáp Án Chi Tiết - Kiengurubrand
-
Cách Tìm Công Thức Phân Tử Của Este Dựa Vào Phản ứng Xà Phòng ...
-
Cách Giải Nhanh Bài Tập Este - Gia Sư Tâm Tài Đức
-
Cách Tìm Công Thức Este - Thả Rông
-
Xác định Công Thức Phân Tử Và Công Thức Cấu Tạo Của Este
-
Tên Gọi Của Este Có Công Thức Phân Tử C4H8O2 Khi Thủy Phân Cho ...
-
Tên Gọi Của Este Có Công Thức Phân Tử C4H8O2khi Thủy Phân Cho ...
-
Tính Chất Hoá Học Của Este, Bài Tập Về Este - Hoá 12 Bài 1 - Hayhochoi
-
Các Phương Trình Của Este – Tính Chất Hoá Học ...
-
Tên Gọi Của Este Có Công Thức Phân Tử C4H8O2 Khi Thủy ...