Hoá Học 10 Bài 30: Lưu Huỳnh - HOC247
Có thể bạn quan tâm
Nội dung bài học Lưu huỳnh tìm hiểu về Cấu tạo phân tử và tính chất vật lí của lưu huỳnh biến đổi như thế nào theo nhiệt độ. Tính chất hóa học của lưu huỳnh có gì đặc biệt? Lưu huỳnh có những ứng dụng quan trọng nào?
ATNETWORK YOMEDIA1. Tóm tắt lý thuyết
1.1. Vị trí, cấu hình electron nguyên tử
1.2. Tính chất vật lí
1.3. Tính chất hóa học
1.4. Ứng dụng của lưu huỳnh
1.5. Trạng thái tự nhiên và sản xuất lưu huỳnh
1.6. Tổng kết
2. Bài tập minh hoạ
3. Luyện tập Bài 30 Hóa học 10
3.1. Trắc nghiệm
3.2. Bài tập SGK và Nâng cao
4. Hỏi đáp về Bài 30 Chương 6 Hóa học 10

Tóm tắt lý thuyết
1.1. Vị trí, cấu hình electron nguyên tử
- Vị trí của nguyên tố S:
- Z = 16
- Chu kì 3
- Nhóm VI A
- Cấu hình e : 1s22s22p63s23p4
- Có 6 e ở lớp ngoài cùng
- Có 2 e độc thân
1.2. Tính chất vật lí
1.2.1. Hai dạng thù hình của lưu huỳnh
-
Dạng thù hình là những đơn chất khác nhau của 1 nguyên tố hóa học. Ví dụ: O2 và O3.
-
Các dạng thù hình của S không tan trong nước nhưng tan nhiều trong benzen, dầu hỏa.
Hình 1: 2 dạng thù hình của lưu huỳnh
| Cấu tạo tinh thể và tính chất vật lí | Lưu huỳnh tà phương (Sα) | Lưu huỳnh đơn tà (Sβ) | Kết luận |
| Cấu tạo tinh thể | 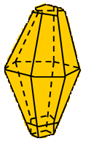 | 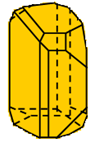 | Cấu tạo khác nhau |
| Khối lượng riêng | 2,07g/cm3 | 1,96g/cm3 | Sα > Sβ |
| Nhiệt độ nóng chảy | 1130C | 1190C | Sα < Sβ |
| Nhiệt độ bền | < 95,50C | 95,50C → 1190C | Sα < Sβ |
- Kết luận: Hai dạng thù hình của S có cấu tạo tinh thể và một số tính chất vật lí khác nhau nhưng tính chất hóa học giống nhau.
1.2.2. Ảnh hưởng của nhiệt độ đến tính chất vật lí
| Nhiệt độ | Trạng thái | Màu | Cấu tạo phân tử | |
 | <1130 | Rắn | Vàng | S8, mạch vòng tinh thể Sβ - Sα |
 | 1190 | Lỏng | Vàng | S8, mạch vòng linh hoạt |
 | >1870 | Quánh | Nâu đỏ | S8 vòng → chuỗi S8 → Sn |
 | >4450 14000 17000 | Hơi Hơi Hơi | Da cam | S6, S4 S2 S |
1.3. Tính chất hóa học
- Cấu hình electron của S: 1s22s22p63s23p4
- S khi tham gia phản ứng với kim loại hoặc Hidro, số oxi hóa của S sẽ giảm từ 0 xuống -2.
- S khi tham gia phản ứng với phi kim hoạt động mạnh hơn như Oxi, Clo, Flo ... số oxi hóa của S tăng từ 0 lên +4 hoặc + 6
1.3.1. Lưu huỳnh tác dụng với kim loại và hiđro
⇒ Ở nhiệt độ cao, lưu huỳnh tác dụng với nhiều kim loại tạo ra muối sunfua và với hiđro tạo ra khí hiđrosunfua, S thể hiện tính oxi hóa.
Hình 1: Khi nhiệt kế vỡ, có thể sử dụng bột lưu huỳnh để tạo muối với thủy ngân,
tránh hơi thủy ngân gây độc.
1.3.2. Lưu huỳnh tác dụng với phi kim
⇒ Ở nhiệt độ thích hợp, lưu huỳnh tác dụng với một số phi kim mạnh hơn, S thể hiện tính khử.
1.3.3. Lưu huỳnh tác dụng với các axit có tính oxi hóa
Video 1: Phản ứng giữa lưu huỳnh và axit nitric đặc nóng
(chứng minh phản ứng có xảy ra bằng cách nhỏ vài giọt dd BaCl2 thấy kết tủa màu trắng của BaSO4
⇒ Lưu huỳnh tác dụng được với các axit có tính oxi hóa, S thể hiện tính khử.
1.3.4. Kết luận
- S vừa thể hiện tính oxi hóa (tác dụng với kim loại và hiđro) vừa thể hiện tính khử (tác dụng với phi kim mạnh hơn và axit có tính oxi hóa).
- Giải thích:
- S có 6 e ở lớp ngoài cùng, nó giống như O, dễ dàng nhận 2 e để đạt cấu hình bền vững của khí hiếm. Độ âm điện của S là 2,58. Do đó S thể hiện tính oxi hóa khi tác dụng với các chất khử (kim loại, hiđro).
- Mặt khác, S thuộc chu kì 3 nên lớp ngoài cùng có thêm phân lớp 3d trống. Trong các phản ứng, S có thể ở trạng thái kích thích và có thể có 4, 6 e độc thân và S dễ dàng cho 4 hoặc 6 e. Do đó S thể hiện tính khử khi tác dụng với các chất có tính oxi hóa (phi kim mạnh hơn, một số axit).
- S có các số oxi hóa: -2, 0, +4, +6
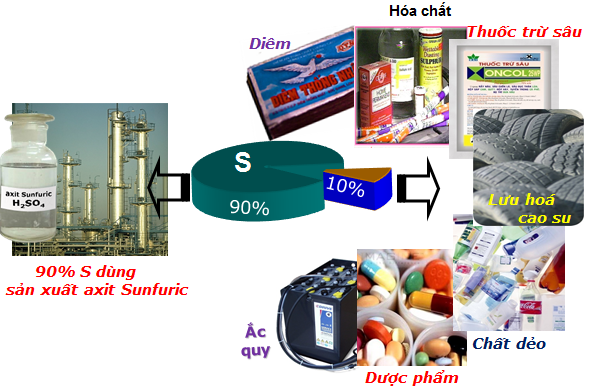
1.4. Ứng dụng của lưu huỳnh
- Lưu huỳnh có nhiều ứng dụng quan trọng trong các ngành công nghiệp:
- 90% lượng lưu huỳnh khai tác được dùng để sản xuất H2SO4.
- 10% lượng lưu huỳnh còn lại được dùng để:
- Lưu hóa cao su;
- Sản xuất diêm, dược phẩm, phẩm nhuộm, chất trừ sâu, diệt nấm...
- S còn là 1 nguyên tố vi lượng cần thiết cho sự sống, S là thành phần của phân bón cho công nghiệp...
- Ngoài ra, S cùng với C, KNO3 với tỉ lệ thích hợp được dùng để sản xuất ra thuốc súng đen.
Phương trình phản ứng: S + 3C + 2KNO3 → K2S + 3CO2 + N2
Hình 2: Ứng dụng của lưu huỳnh
1.5. Trạng thái tự nhiên và sản xuất lưu huỳnh
Trạng thái tự nhiên của S:
- Dạng đơn chất: ở các mỏ lưu huỳnh, các mỏ chủ yếu tập trung gần các miệng núi lửa, suối nước nóng…
- Dạng hợp chất: muối sunfat, muối sunfua…
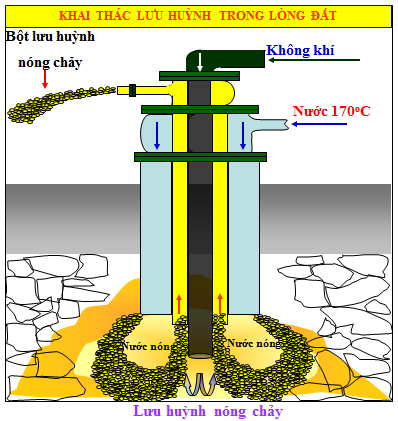
Khai thác lưu huỳnh từ các mỏ lưu huỳnh: người ta dùng thiết bị đặc biệt để nén nước siêu nóng (1700C) vào mỏ làm lưu huỳnh nóng chảy và đẩy lên mặt đất. Sau đó lưu huỳnh được tách ra khỏi các tạp chất.
2 H2S + O2(thiếu) .PNG)
2 H2S + SO2 → 2 H2O + 3 S
Hình 3: Thiết bi khai thác lưu huỳnh (phương pháp Frasch)
1.6. Tổng kết
Hình 4: Sơ đồ tư duy bài lưu huỳnh
Bài tập minh họa
Bài 1:
Vì sao nên hạn chế sử dụng măng khô, đũa dùng một lần, tăm tre?
Hướng dẫn:
Măng khô, đũa dùng 1 lần, tăm tre thường được xông lưu huỳnh để diệt mốc, ngăn chặn mốc phát triển. Lưu huỳnh gây bệnh đường hô hấp. Quá trình xông thường sinh khí SO2 có mùi khó chịu – đó chính là khí độc, có ảnh hưởng tới môi trường, sức khỏe của người chế biến và người sống xung quanh.
Bài 2:
Đun nóng hỗn hợp gồm 11,2g bột sắt và 3,2g bột lưu huỳnh, cho sản phẩm tạo thành vào 500ml dung dịch HCl thu đc hỗn hợp khí và dd A. Để trung hòa HCl còn dư trong dd A phải dùng 250ml dung dịch NaOH 0,1M. Tính nồng độ mol/l của dd HCl đã dùng.
Hướng dẫn:
Phương trình phản ứng:
Fe + S → FeS (1) FeS + 2HCl → FeCl2 + H2S (2) Fe + 2HCl → FeCl2 + H2 (3) HCl + NaOH →NaCl + H2O (4) Số mol của sắt và lưu huỳnh là:
nFe=0,2 mol, nS =0,1 mol.
Phản ứng xảy ra thu được 0,1mol FeS và 0,1mol Fe dư .
Phương trình (4) nNaOH = nHCl .
Vậy nHCl đã dùng là = 2nFeS + 2nFe dư + nNaOH = 0,2 + 0,2 + 0,025 = 0,425 mol Vậy CM (HCl) = n/ v = 0,425/0,5 = 0,85M
Bài 3:
Cho sản phẩm tạo thành khi đun nóng hỗn hợp gồm 5,6g bột Fe và 1,6g bột S vào 500ml dd HCl thì thu được hỗn hợp khí bay ra và 1 dd B. Hiệu suất phản ứng là 100%. a) Tính thành phần phần trăm về thể tích mỗi khí trong hh khí b) Để trung hoà HCl còn thừa trong dd A phải dùng 125ml dd NaOH 0,1M. Tính CM HCl đã dùng.
Hướng dẫn:
Tính số mol từng chất
nFe = 0,1 mol nS = 0,05 mol Fe + S .PNG)
⇒ Thành phần phần trăn từng khí là 50% H2S và 50% H2 b)
nNaOH = 0,0125mol NaOH + HCl → NaCl + H2O 0,0125 0,0125 Ta có số mol HCl là =0,1+0,1+0,0125=0,2125,ol ⇒ CMHCl = 0,2125/0,5 = 0,425M
3. Luyện tập Bài 30 Hóa học 10
Sau bài học cần nắm:
- Lưu huỳnh trong tự nhiên tồn tại ở hai dạng thù hình: lưu huỳnh tà phương (Sα) và lưu huỳnh đơn tà (Sβ).
- Ảnh hưởng của nhiệt độ đến cấu tạo phân tử và tính chất vật lý của lưu huỳnh.
- Tính chất hóa học cơ bản của là vừa có tính oxi hóa vừa có tính khử và trong hợp chất lưu huỳnh có số oxi hóa là -2, +4, +6.
- Sự biến đổi về tính cấu tạo phân tử và tính chất vật lý của lưu huỳnh theo nhiệt độ.
- Nguyên nhân lưu huỳnh vừa có tính khử vừa có tính oxi hóa.
- So sánh tính chất hóa học của oxi và lưu huỳnh. Tầm quan trọng của lưu huỳnh trong cuộc sống.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 10 Bài 30 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
Câu 1:
Đơn chất nào sau đây vừa có tính oxi hóa, vừa có tính khử?
- A. O2
- B. O3
- C. S
- D. F2
-
Câu 2:
Phát biểu nào sau đây chưa đúng:
- A. Lưu huỳnh tà phương (Sα) bền hơn lưu huỳnh đơn tà (Sβ) ở nhiệt độ thường.
- B. Trong hợp chất, lưu huỳnh có số oxi hóa -2, +2, +4, +6.
- C. Lưu huỳnh thể hiện tính khử khi tác dụng với một số phi kim (F2, O2, Cl2, …)
- D. Thủy ngân (Hg) có thể tác dụng với lưu huỳnh ở nhiệt độ thường.
-
Câu 3:
Nhận định nào sau đây phản ánh đúng tính chất hóa học của lưu huỳnh ?
- A. Lưu huỳnh chỉ có tính oxi hóa.
- B. Lưu huỳnh chỉ có tính khử.
- C. Lưu huỳnh vừa có tính khử vừa có tính oxi hóa.
- D. Lưu huỳnh không có tính oxi hóa và không có tính khử.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 10 Bài 30.
Bài tập 1 trang 132 SGK Hóa học 10
Bài tập 2 trang 132 SGK Hóa học 10
Bài tập 3 trang 132 SGK Hóa học 10
Bài tập 4 trang 132 SGK Hóa học 10
Bài tập 5 trang 132 SGK Hóa học 10
Bài tập 30.1 trang 66 SBT Hóa học 10
Bài tập 30.2 trang 66 SBT Hóa học 10
Bài tập 30.3 trang 66 SBT Hóa học 10
Bài tập 30.4 trang 66 SBT Hóa học 10
Bài tập 30.5 trang 67 SBT Hóa học 10
Bài tập 30.6 trang 67 SBT Hóa học 10
Bài tập 30.7 trang 67 SBT Hóa học 10
Bài tập 30.8 trang 67 SBT Hóa học 10
Bài tập 30.9 trang 67 SBT Hóa học 10
Bài tập 30.10 trang 68 SBT Hóa học 10
Bài tập 30.11 trang 68 SBT Hóa học 10
Bài tập 1 trang 172 SGK Hóa học 10 nâng cao
Bài tập 2 trang 172 SGK Hóa học 10 nâng cao
Bài tập 3 trang 172 SGK Hóa học 10 nâng cao
Bài tập 4 trang 172 SGK Hóa học 10 nâng cao
4. Hỏi đáp về Bài 30 Chương 6 Hóa học 10
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
 NONE
NONE Bài học cùng chương
 Hoá học 10 Bài 29: Oxi - Ozon
Hoá học 10 Bài 29: Oxi - Ozon  Hoá học 10 Bài 31: Bài thực hành số 4 Tính chất của oxi, lưu huỳnh
Hoá học 10 Bài 31: Bài thực hành số 4 Tính chất của oxi, lưu huỳnh  Hoá học 10 Bài 32: Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit
Hoá học 10 Bài 32: Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit  Hoá học 10 Bài 33: Axit sunfuric - Muối sunfat
Hoá học 10 Bài 33: Axit sunfuric - Muối sunfat  Hoá học 10 Bài 34: Luyện tập Oxi và lưu huỳnh
Hoá học 10 Bài 34: Luyện tập Oxi và lưu huỳnh  Hoá học 10 Bài 35: Bài thực hành số 5 Tính chất các hợp chất của lưu huỳnh ADSENSE TRACNGHIEM
Hoá học 10 Bài 35: Bài thực hành số 5 Tính chất các hợp chất của lưu huỳnh ADSENSE TRACNGHIEM  Bộ đề thi nổi bật
Bộ đề thi nổi bật  UREKA AANETWORK
UREKA AANETWORK 
XEM NHANH CHƯƠNG TRÌNH LỚP 10
Toán 10
Toán 10 Kết Nối Tri Thức
Toán 10 Chân Trời Sáng Tạo
Toán 10 Cánh Diều
Giải bài tập Toán 10 Kết Nối Tri Thức
Giải bài tập Toán 10 CTST
Giải bài tập Toán 10 Cánh Diều
Trắc nghiệm Toán 10
Đề thi giữa HK2 môn Toán 10
Ngữ văn 10
Ngữ Văn 10 Kết Nối Tri Thức
Ngữ Văn 10 Chân Trời Sáng Tạo
Ngữ Văn 10 Cánh Diều
Soạn Văn 10 Kết Nối Tri Thức
Soạn Văn 10 Chân Trời Sáng tạo
Soạn Văn 10 Cánh Diều
Văn mẫu 10
Đề thi giữa HK2 môn Ngữ Văn 10
Tiếng Anh 10
Giải Tiếng Anh 10 Kết Nối Tri Thức
Giải Tiếng Anh 10 CTST
Giải Tiếng Anh 10 Cánh Diều
Trắc nghiệm Tiếng Anh 10 KNTT
Trắc nghiệm Tiếng Anh 10 CTST
Trắc nghiệm Tiếng Anh 10 CD
Giải Sách bài tập Tiếng Anh 10
Đề thi giữa HK2 môn Tiếng Anh 10
Vật lý 10
Vật lý 10 Kết Nối Tri Thức
Vật lý 10 Chân Trời Sáng Tạo
Vật lý 10 Cánh Diều
Giải bài tập Lý 10 Kết Nối Tri Thức
Giải bài tập Lý 10 CTST
Giải bài tập Lý 10 Cánh Diều
Trắc nghiệm Vật Lý 10
Đề thi giữa HK2 môn Vật Lý 10
Hoá học 10
Hóa học 10 Kết Nối Tri Thức
Hóa học 10 Chân Trời Sáng Tạo
Hóa học 10 Cánh Diều
Giải bài tập Hóa 10 Kết Nối Tri Thức
Giải bài tập Hóa 10 CTST
Giải bài tập Hóa 10 Cánh Diều
Trắc nghiệm Hóa 10
Đề thi giữa HK2 môn Hóa 10
Sinh học 10
Sinh học 10 Kết Nối Tri Thức
Sinh học 10 Chân Trời Sáng Tạo
Sinh học 10 Cánh Diều
Giải bài tập Sinh 10 Kết Nối Tri Thức
Giải bài tập Sinh 10 CTST
Giải bài tập Sinh 10 Cánh Diều
Trắc nghiệm Sinh học 10
Đề thi giữa HK2 môn Sinh 10
Lịch sử 10
Lịch Sử 10 Kết Nối Tri Thức
Lịch Sử 10 Chân Trời Sáng Tạo
Lịch Sử 10 Cánh Diều
Giải bài tập Lịch Sử 10 KNTT
Giải bài tập Lịch Sử 10 CTST
Giải bài tập Lịch Sử 10 Cánh Diều
Trắc nghiệm Lịch sử 10
Đề thi giữa HK2 môn Lịch Sử 10
Địa lý 10
Địa Lý 10 Kết Nối Tri Thức
Địa Lý 10 Chân Trời Sáng Tạo
Địa Lý 10 Cánh Diều
Giải bài tập Địa Lý 10 KNTT
Giải bài tập Địa Lý 10 CTST
Giải bài tập Địa Lý 10 Cánh Diều
Trắc nghiệm Địa lý 10
Đề thi giữa HK2 môn Địa lý 10
GDKT & PL 10
GDKT & PL 10 Kết Nối Tri Thức
Đề thi giữa HK2 môn GDCD 10
GDKT & PL 10 Chân Trời Sáng Tạo
GDKT & PL 10 Cánh Diều
Giải bài tập GDKT & PL 10 KNTT
Giải bài tập GDKT & PL 10 CTST
Giải bài tập GDKT & PL 10 CD
Trắc nghiệm GDKT & PL 10
Công nghệ 10
Công nghệ 10 Kết Nối Tri Thức
Công nghệ 10 Chân Trời Sáng Tạo
Công nghệ 10 Cánh Diều
Giải bài tập Công nghệ 10 KNTT
Giải bài tập Công nghệ 10 CTST
Giải bài tập Công nghệ 10 CD
Trắc nghiệm Công nghệ 10
Đề thi giữa HK2 môn Công nghệ 10
Tin học 10
Tin học 10 Kết Nối Tri Thức
Tin học 10 Chân Trời Sáng Tạo
Tin học 10 Cánh Diều
Giải bài tập Tin học 10 KNTT
Giải bài tập Tin học 10 CTST
Giải bài tập Tin học 10 Cánh Diều
Trắc nghiệm Tin học 10
Đề thi giữa HK2 môn Tin học 10
Cộng đồng
Hỏi đáp lớp 10
Tư liệu lớp 10
Xem nhiều nhất tuần
Đề thi giữa HK2 lớp 10
Đề thi giữa HK1 lớp 10
Đề thi HK1 lớp 10
Đề thi HK2 lớp 10
Video bồi dưỡng HSG môn Toán
Toán 10 Chân trời sáng tạo Bài 2: Tập hợp
Toán 10 Kết nối tri thức Bài 1: Mệnh đề
Toán 10 Cánh Diều Bài tập cuối chương 1
Soạn bài Ra-ma buộc tội - Ngữ văn 10 Tập 1 Cánh Diều
Soạn bài Chữ người tử tù - Nguyễn Tuân - Ngữ văn 10 KNTT
Soạn bài Thần Trụ Trời - Ngữ văn 10 CTST
Văn mẫu về Cảm xúc mùa thu (Thu hứng)
Văn mẫu về Bình Ngô đại cáo
Văn mẫu về Chữ người tử tù
Văn mẫu về Tây Tiến
YOMEDIA YOMEDIA ×Thông báo
Bạn vui lòng đăng nhập trước khi sử dụng chức năng này.
Bỏ qua Đăng nhập ×Thông báo
Bạn vui lòng đăng nhập trước khi sử dụng chức năng này.
Đồng ý ATNETWORK ON QC Bỏ qua >>
QC Bỏ qua >> 
Từ khóa » Tính Chất Của Lưu Huỳnh Kết Tủa
-
Lưu Huỳnh – Wikipedia Tiếng Việt
-
TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA LƯU ...
-
Lưu Huỳnh Là Gì? Tính Chất Vật Lí, Tính Chất Hóa Học - Tác Dụng, ứng ...
-
Tính Chất Hoá Học Của Lưu Huỳnh (S), Bài Tập Về Lưu ... - Hayhochoi
-
Tính Chất Của Lưu Huỳnh Kết Tủa | Leo-đè
-
Lưu Huỳnh Và Những điều Có Thể Bạn Chưa Biết Về Phi Kim Này
-
Hidro Sunfua (H2S), Lưu Huỳnh Dioxit (SO2), Lưu Huỳnh Trioxit (SO3 ...
-
Tính Chất Hóa Học Của Lưu Huỳnh, Cách Điều Chế Và Các Ứng ...
-
Lý Thuyết Hợp Chất Của Lưu Huỳnh Hay, Chi Tiết Nhất
-
Tính Chất Hóa Học Của Các Hợp Chất Của Lưu Huỳnh - 123doc
-
Bài 35. Bài Thực Hành Số 5. Tính Chất Các Hợp Chất Của Lưu Huỳnh
-
Tính Chất Hóa Học Của Hidro Sunfua H2S, Lưu Huỳnh Dioxit SO2 ...
-
Tính Chất Hóa Học Của Các Hợp Chất Của Lưu Huỳnh - Tài Liệu Text




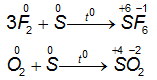

.PNG)
