Hydro Chloride – Wikipedia Tiếng Việt
Có thể bạn quan tâm
| Bài viết này cần thêm chú thích nguồn gốc để kiểm chứng thông tin. Mời bạn giúp hoàn thiện bài viết này bằng cách bổ sung chú thích tới các nguồn đáng tin cậy. Các nội dung không có nguồn có thể bị nghi ngờ và xóa bỏ. (Tìm hiểu cách thức và thời điểm xóa thông báo này) |
 | |
| Danh pháp IUPAC | Hydro chlorideChloran |
|---|---|
| Tên khác | Acid hydrochloricKhí acid hydrochloric |
| Nhận dạng | |
| Số CAS | [7747-01-0] [7747-01-0] |
| Số RTECS | MW4025000 |
| Thuộc tính | |
| Công thức phân tử | HCl (khí) |
| Khối lượng mol | 36,4606 g/mol |
| Bề ngoài | Khí không màu, ưa ẩm |
| Khối lượng riêng | 1,477 g/L |
| Điểm nóng chảy | -114,2 °C (158,8 K) |
| Điểm sôi | -85,1 °C (187,9 K) |
| Độ hòa tan trong nước | 720g/L (20°C) |
| Độ axit (pKa) | -8 |
| Cấu trúc | |
| Cấu trúc tinh thể | n εr, v.v. |
| Nhiệt hóa học | |
| Enthalpyhình thành ΔfHo298 | Các trạng tháirắn, lỏng, khí |
| Các nguy hiểm | |
| Nguy hiểm chính | Độc hại, chất ăn mòn |
| NFPA 704 |
|
| Điểm bắt lửa | Không cháy |
| Các hợp chất liên quan | |
| Hợp chất liên quan | HFHBrHI |
| Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). Tham khảo hộp thông tin | |
Hydro chloride (công thức hóa học: HCl) là một chất khí không màu, độc hại, có tính ăn mòn cao, tạo thành khói trắng khi tiếp xúc với hơi ẩm. Hơi trắng này là acid hydrochloric được tạo thành khi hydro chloride hòa tan trong nước. Hydro chloride cũng như acid hydrochloric là các hóa chất quan trọng trong công nghiệp hóa chất, khoa học, công nghệ. Tên gọi HCl thông thường hay được dùng để chỉ (một mức độ nào đó là không hoàn toàn chính xác) acid hydrochloric thay vì để chỉ hydro chloride ở trạng thái khí.
Hóa học
[sửa | sửa mã nguồn]Phân tử hydro chloride (HCl) là một phân tử hai nguyên tử đơn giản, bao gồm một nguyên tử hydro và một nguyên tử chlor kết hợp với nhau thông qua một liên kết đơn cộng hóa trị. Do nguyên tử chlor có độ âm điện cao hơn so với nguyên tử hydro nên liên kết cộng hóa trị này là phân cực rõ ràng. Do phân tử tổng thể có mômen lưỡng cực lớn với điện tích một phần âm δ- tại nguyên tử chlor và điện tích dương δ+ tại nguyên tử hydro, nên phân tử hai nguyên tử hydro chloride là phân tử phân cực mạnh. VÌ thế, nó rất dễ dàng hòa tan trong nước cũng như trong các dung môi phân cực khác.
Khi tiếp xúc với nước, nó nhanh chóng bị ion hóa, tạo thành các cation hydro (H3O+) và các anion chloride (Cl-) thông qua phản ứng hóa học thuận nghịch sau:
HCl + H2O → H3O+ + Cl−Dung dịch tạo thành được gọi là acid hydrochloric và nó là một acid mạnh. Hằng số điện li acid hay hằng số ion hóa Ka là rất lớn, nghĩa là HCl bị điện li hay ion hóa toàn phần trong nước.
Kể cả khi không có mặt nước thì hydro chloride vẫn có thể có phản ứng như một acid. Ví dụ, hydro chloride có thể hòa tan trong các dung môi phân cực khác như methanol và có phản ứng như một chất xúc tác acid cho các phản ứng hóa học khi điều kiện khan nước (anhiđrơ) là mong muốn.
HCl + CH3OH → CH3O+H2 + Cl−HCl cung cấp proton cho phân tử methanol (CH3OH)
Do bản chất acid của nó, hydro chloride là một chất khí có tính ăn mòn, cụ thể là khi có sự hiện diện của hơi ẩm.

Tác hại cho sức khỏe
[sửa | sửa mã nguồn]Hydro chloride tạo thành acid hydrochloric có tính ăn mòn cao khi tiếp xúc với cơ thể. và có khả năng tử vong Việc hít thở phải hơi khói gây ra ho, nghẹt thở, viêm mũi, họng và phần phía trên của hệ hô hấp. Trong những trường hợp nghiêm trọng là phù phổi, tê liệt hệ tuần hoàn và tử vong. Tiếp xúc với da có thể gây mẩn đỏ, các thương tổn hay bỏng nghiêm trọng. Nó cũng có thể gây ra mù mắt trong những trường hợp nghiêm trọng.
Lịch sử
[sửa | sửa mã nguồn]Các nhà giả kim thuật kể từ thời Trung cổ đã nhận ra rằng acid hydrochloric (khi đó gọi là rượu của muối hay acidum salis) sinh ra hydro chloride ở dạng hơi, khi đó gọi là marine acid air (khí acid biển).
Trong thế kỷ XVII, Johann Rudolf Glauber sử dụng muối (natri chloride) và acid sulfuric để điều chế natri sunfat, giải phóng ra khí hydro chloride.
2NaCl + H2SO4 → 2HCl + Na2SO4Năm 1772, Carl Wilhelm Scheele cũng thực hiện phản ứng này và đôi khi được coi là người phát hiện ra nó. Joseph Priestley điều chế được hydro chloride tinh chất vào năm 1772 và vào năm 1818 thì Humphry Davy chứng minh rằng nó là hợp chất của hydro và chlor.
Trong thời kỳ cách mạng công nghiệp, nhu cầu về các hợp chất kiềm như natri carbonat (Na2CO3) đã tăng lên và Nicolas Leblanc đã phát triển một công nghệ mới ở quy mô công nghiệp để sản xuất tro xô đa. Trong công nghệ Leblanc, muối ăn được chuỷển hóa thành tro xô đa bằng acid sunfuric, đá vôi và than, tạo ra hydro chloride như một sản phẩm phụ. Ban đầu, nó đã bị xả ra ngoài không khí, nhưng đạo luật Kiềm năm 1863 đã nghiêm cấm việc xả khí này, vì thế các nhà sản xuất tro xô đa đã cho hấp thụ khí thải HCl trong nước, tạo ra acid hydrochloric với sản lượng quy mô công nghiệp. Sau đó công nghệ Hargreaves đã được tạo ra, nó là tương tự như công nghệ Leblanc, ngoại trừ việc người ta sử dụng lưu huỳnh dioxide, nước, không khí thay cho acid sulfuric trong phản ứng là tỏa nhiệt về tổng thể. Trong đầu thế kỷ XX thì công nghệ Leblanc đã được thay thế bằng công nghệ Solvay, nó không sinh ra HCl. Tuy nhiên, việc sản xuất hydro chloride vẫn được tiếp tục như là một bước trong sản xuất acid hydrochloric.
Các công dụng lịch sử của hydro chloride trong thế kỷ XX bao gồm hydrochloricnat hóa các Ankyl trong sản xuất các monomer chlor hóa như chloropren (CH2=CCl-CH=CH2) và Vinyl chloride (CH2=CHCl), để sau đó nhờ polymer hóa sinh ra polychloropren (neopren) và polyvinyl chloride (PVC). Trong sản xuất vinyl chloride, acetylen (C2H2) được hydrochloricnat hóa bằng cách bổ sung HCl vào để phá vỡ liên kết ba của phân tử C2H2, tạo ra liên kết đôi, sinh ra vinyl chloride.
"Công nghệ acetylen", được sử dụng cho tới thập niên 1960 để sản xuất chloropren, bắt đầu bằng việc kết nối hai phân tử acetylen, sau đó bổ sung HCl vào chất trung gian đã kết nối thông qua liên kết ba để chuyển nó thành chloropren như chỉ ra dưới đây:
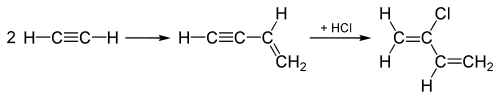
Công nghệ acetylen này đã được thay thế bằng công nghệ khác, trong đó người ta bổ sung Cl2 vào một trong các liên kết đôi trong 1,3-butadien (CH2=CH-CH=CH2), và kết quả là có thể sản sinh ra chloropren và HCl.
Hiện nay, phần lớn hydro chloride được sản xuất ra để sản xuất acid hydrochloric.

Sản xuất
[sửa | sửa mã nguồn]Tổng hợp trực tiếp
[sửa | sửa mã nguồn]Trong công nghiệp chloralkali, dung dịch muối ăn được điện phân để sản xuất chlor (Cl2), natri hydroxide và hydro (H2). Khí chlor nguyên chất có thể tái tổ hợp trong lò sản xuất HCl với khí hydro, tạo ra hydro chloride nguyên chất.
Cl2 + H2 → 2HClPhản ứng này tỏa nhiệt.
Khí tạo ra được hấp thụ trong nước tinh khiết (nước đã khử hết các ion khác), tạo ra acid hydrochloric tinh khiết. Phản ứng này có thể sử dụng để tạo ra sản phẩm rất tinh khiết cho công nghiệp thực phẩm.
Tổng hợp hữu cơ
[sửa | sửa mã nguồn]Một lượng lớn acid hydrochloric được sinh ra trong quá trình chloricnat hóa hay fluorinat hóa các hợp chất hữu cơ, chẳng hạn teflon, freon và các CFC khác, acid chloroacetic, và PVC. Thông thường việc sản xuất HCl như thế được sử dụng ngay tại chỗ.
R-H + Cl2 → R-Cl + HCl R-Cl + HF → R-F + HClKhí HCl sinh ra hoặc được tái sử dụng trực tiếp, hoặc được nước hấp thụ, tạo thành acid hydrochloric cấp kỹ thuật hay công nghiệp.
Phòng thí nghiệm
[sửa | sửa mã nguồn]Một lượng nhỏ khí HCl sử dụng trong phòng thí nghiệm có thể sản xuất bằng cách khử nước của acid hydrochloric theo 2 cách:
- Giải phóng ra nhờ bổ sung acid sulfuric đậm đặc vào dung dịch acid hydrochloric đậm đặc.
- Giải phóng ra nhờ bổ sung calci chloride khan vào dung dịch acid hydrochloric đậm đặc.
Ngoài ra, HCl có thể sinh ra nhờ phản ứng của acid sulfuric với natri chloride:
NaCl + H2SO4 → NaHSO4 + HCl↑Những phòng thí nghiệm bí mật và bất hợp pháp nói chung sử dụng khí HCl sinh ra theo cách này để chuyển hóa các loại ma túy gốc tự do thành dạng các muối hydro chloride nhằm dễ dàng phân phối hơn.
HCl cũng có thể điều chế bằng cách thủy phân một số hợp chất chứa chloride hoạt hóa như phosphor chloride, thionyl chloride (SOCl2) và các acyl chloride (R-CO-Cl). Bổ sung thêm nước có thể hấp thụ khí HCl để tạo thành acid hydrochloric. Ví dụ, nước lạnh có thể nhỏ giọt từ từ vào phosphor pentachloride (PCl5) để tạo ra HCl theo phản ứng:
PCl5 + H2O → POCl3 + 2HClNước nóng có thể giải phóng ra nhiều khí HCl hơn nhờ thủy phân PCl5 thành acid orthophosphoric. Phản ứng của nước với phosphor trichloride (PCl3) cũng sinh ra HCl.
Phản ứng của thionyl chloride với nước sinh ra lưu huỳnh dioxide (SO2) cũng như HCl. Đối với các phản ứng này, xem bài thionyl chloride và acyl halide.
Ứng dụng
[sửa | sửa mã nguồn]Một số ứng dụng của hydro chloride là:
- Sản xuất acid hydrochloric.
- Hydrochloricnat hóa cao su.
- Sản xuất các chloride vinyl và alkyl.
- Trung gian hóa học trong các sản xuất hóa chất khác.
- Làm chất trợ chảy babit.
- Xử lý bông.
- Trong công nghiệp bán dẫn (loại tinh khiết).
- Khắc các tinh thể bán dẫn.
- Chuyển silic thành SiHCl3 để làm tinh khiết silic.
Hydro chloride thông thường chứa trong các bình nén với ký hiệu đỏ và nâu/xám với dải vàng.
Xem thêm
[sửa | sửa mã nguồn]- Chloride, các muối vô cơ của acid hydrochloric.
- Hydrochloride, các muối hữu cơ của acid hydrochloric.
Tham khảo
[sửa | sửa mã nguồn]Liên kết ngoài
[sửa | sửa mã nguồn]- Thẻ an toàn hóa chất quốc tế số 0163
- Dữ liệu hóa chất của hiđrô chlorrua
- Bảng an toàn hóa chất (MSDS) Lưu trữ ngày 20 tháng 2 năm 2007 tại Wayback Machine
- Dữ liệu hóa chất Lưu trữ ngày 2 tháng 2 năm 2007 tại Wayback Machine
- Hóa điện toán trên Wiki Lưu trữ ngày 11 tháng 3 năm 2007 tại Wayback Machine
| |
|---|---|
|
| |
|---|---|
| Oxide và một số ion |
|
| Acid |
|
| Muối |
|
| Hữu cơ |
|
| |
Từ khóa » Công Thức Electron Của Hidro Clorua
-
[LỜI GIẢI] Chọn Công Thức Electron đúng Của Phân Tử Hiđro Clorua
-
Hoá Học 10 Bài 23: Hiđro Clorua - Axit Clohiđric Và Muối Clorua
-
Công Thức Cấu Tạo Của Phân Tử HCl Là H - Cl
-
[CHUẨN NHẤT] Công Thức Cấu Tạo Của HCl - TopLoigiai
-
Bài 23: Hiđro Clorua - Axit Clohidric Và Muối Clorua - Hoc24
-
Bài 3. Hiđro Clorua – Axit Clohiđric Và Muối Clorua
-
Lý Thuyết Về Hidro Clorua - Axit Clohidric Và Muối Clorua
-
Tìm Hiểu Về Tính Chất Hiđro Clorua - Tài Liệu Text - 123doc
-
Cấu Tạo Phân Tử. Tính Chất Vật Lí. Hiđro Clorua Tan Vào Nước Tạo Tính
-
Top 14 Công Thức Electron Của Hcl - Thư Viện Hỏi Đáp
-
Công Thức Electron Của HCl Là H :Cl:
-
Bài 23. Hiđro Clorua, Axit Clohiđric Và Muối Clorua - SureTEST
-
Chọn Công Thức Electron đúng Của Phân Tử Hiđro Clorua:
