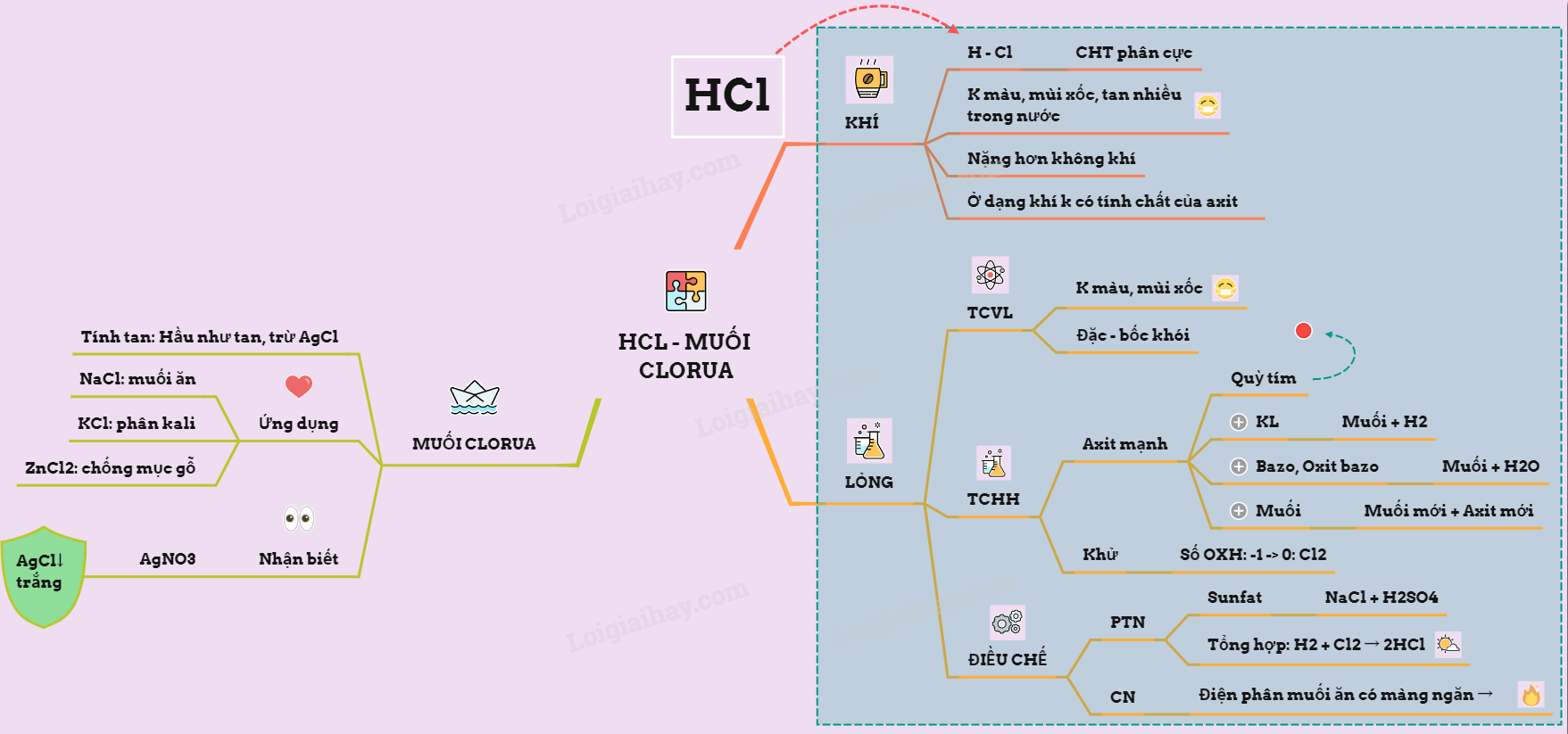
Lý Thuyết Về Hidro Clorua - Axit Clohidric Và Muối Clorua
Có thể bạn quan tâm
I. Hiđroclorua
1. Cấu tạo phân tử: H – Cl: Là hợp chất cộng hóa trị phân cực
2. Tính chất vật lí: là chất khí không màu, mùi sốc, nặng hơn không khí, tan tốt trong nước
II. Axit clohiđric
1. Tính chất vật lí
- Hiđro clorua tan vào trong nước tạo thành dung dịch axit clohiđric
- Axit clohiđric là chất lỏng không màu, mùi sốc, nồng độ đặc nhất ở 20oC đạt tới nồng độ 37%
- Dung dịch HCl đặc “ bốc khói” trong không khí ẩm là do hiđro clorua thoát ra tạo với hơi nước trong không khí thành
những hạt dung dịch nhỏ như sương mù
2. Tính chất hóa học
- Là một axit mạnh, có đầy đủ tính chất hóa học chung của axit: làm cho quỳ tím chuyển sang đỏ.
a) Tác dụng với kim loại
Dung dịch HCl tác dụng với kim loại đứng trước H trong tạo muối (trong đó kim loại có hóa trị thấp) và giải phóng khí hiđro
Fe + 2HCl → FeCl2 + H2
b) Tác dụng với bazơ, oxit bazơ tạo muối và nước
NaOH + HCl → NaCl + H2O
CuO + 2HCl → CuCl2 + H2O
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
c) Tác dụng với một số muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2
AgNO3 + HCl → AgCl + HNO3
(dùng để nhận biết gốc clorua)
* Có tính khử do Clo trong HCl có số oxi hóa thấp nhất là -1, khi tác dụng với chất oxi hóa mạnh thì HCl bị oxi hóa thành Cl2
\(\begin{gathered} Mn{O_2} + 4HCl\xrightarrow{{{t^o}}}MnC{l_2} + C{l_2} + 2{H_2}O \hfill \\ 2KMn{O_4} + 16HCl \to 2MnC{l_2} + 2KCl + 5C{l_2} + 8{H_2}O \hfill \\ \end{gathered} \)
3. Điều chế
a) Trong phòng thí nghiệm:
- Phương pháp sunfat
\(\begin{gathered}NaCl + {H_2}S{O_4}\xrightarrow{{ < {{250}^o}C}}NaHS{O_4} + HCl \hfill \\ 2NaCl + {H_2}S{O_4}\xrightarrow{{ > {{400}^o}C}}N{a_2}S{O_4} + 2HCl \hfill \\ \end{gathered} \)
- Phướng pháp tổng hợp:
H2 + Cl2\(\xrightarrow{{{as}}}\) 2HCl hidro clorua.
b) Trong công nghiệp: Đốt khí Clo và hiđro thu được sau quá trình điện phân muối ăn bão hòa trong khí quyển
\({\mathop H\limits^0 _2} + {\mathop {Cl}\limits^0 _2} \to 2\mathop H\limits^{ + 1} \mathop {Cl}\limits^{ - 1} \)
III. Muối clorua và nhận biết ion clorua
1. Muối clorua
- Đa số các muối tan nhiều trong nước, trừ một số muối không tan như AgCl và ít tan như CuCl, PbCl2
- Muối clorua có nhiều ứng dụng quan trọng như KCl làm phân kali; ZnCl2 dùng để chống gỗ mục vì muối này có khả năng diệt khuẩn, AlCl3 dùng làm chất xúc tác trong tổng hợp hữu cơ; BaCl2 dùng để diệt trừ sâu bệnh,…
- Muối clorua quan trọng nhất là NaCl, dùng làm muối ăn và bảo quản thực phẩm; là nguyên liệu quan trọng đối với ngành công nghiệp hóa chất điều chế khí clo, hiđro,…
2. Nhận biết ion Clorua: dùng dung dịch Bạc nitrat AgNO3 \( \to\) xuất hiện kết tủa trắng AgCl không tan trong các dung dịch axit mạnh
Sơ đồ tư duy: Hidro clorua - axit clohidric và muối clorua
Loigiaihay.com
Từ khóa » Công Thức Electron Của Hidro Clorua
-
[LỜI GIẢI] Chọn Công Thức Electron đúng Của Phân Tử Hiđro Clorua
-
Hoá Học 10 Bài 23: Hiđro Clorua - Axit Clohiđric Và Muối Clorua
-
Công Thức Cấu Tạo Của Phân Tử HCl Là H - Cl
-
[CHUẨN NHẤT] Công Thức Cấu Tạo Của HCl - TopLoigiai
-
Bài 23: Hiđro Clorua - Axit Clohidric Và Muối Clorua - Hoc24
-
Bài 3. Hiđro Clorua – Axit Clohiđric Và Muối Clorua
-
Tìm Hiểu Về Tính Chất Hiđro Clorua - Tài Liệu Text - 123doc
-
Cấu Tạo Phân Tử. Tính Chất Vật Lí. Hiđro Clorua Tan Vào Nước Tạo Tính
-
Hydro Chloride – Wikipedia Tiếng Việt
-
Top 14 Công Thức Electron Của Hcl - Thư Viện Hỏi Đáp
-
Công Thức Electron Của HCl Là H :Cl:
-
Bài 23. Hiđro Clorua, Axit Clohiđric Và Muối Clorua - SureTEST
-
Chọn Công Thức Electron đúng Của Phân Tử Hiđro Clorua: