Lý Thuyết Hóa 10: Bài 25. Flo - Brom - Iot - TopLoigiai
Có thể bạn quan tâm
Lý thuyết Hóa 10 Bài 25. Flo - brom - iot
I. FLO
1. Tính chất vật lí và trạng thái tự nhiên
- Ở điều kiện thường, flo là chất khí màu lục nhạt, rất độc.
- Trong tự nhiên, flo chỉ tồn tại ở dạng hợp chất. Hợp chất của flo có trong men răng của người và động vật, trong lá của một số loài cây, phần lớn tập trung trong 2 khoáng vật: Florit (CaF2), Criolit (Na3AlF6 hay AlF3.3NaF ).
2. Tính chất hóa học
- Flo có độ âm điện lớn nhất ⟶ flo là phi kim mạnh nhất.
a) Tác dụng với kim loại
- Flo oxi hóa hầu hết các kim loại kể cả Au và Pt.
2Au + 3F2 ⟶ 2AuF3 (Vàng florua)
2Fe + 3F2 ⟶ 2FeF3 (Sắt(III) florua)
b) Tác dụng với phi kim
- Flo tác dụng trực tiếp với hầu hết phi kim, trừ oxi và nitơ.
2F2+C⟶CF4
c) Tác dụng với hiđro
- Flo tác dụng với hiđro ngay ở nhiệt độ thấp (–252oC).
H2 (k) + F2(k) ⟶ 2HF(k)
ΔH = −577,2 kJ
(Phản ứng gây nổ mạnh ở nhiệt độ rất thấp)
d) Tác dụng với nước
- Khí flo oxi hóa nước ngay ở nhiệt độ thường, hơi nước nóng bốc cháy khi tiếp xúc với khí flo.
2F2 +2H2O ⟶ 4HF + O2
3. Ứng dụng
- Điều chế dẫn xuất flo để sản xuất chất dẻo.
- Dùng trong công nghiệp hạt nhân để làm giàu 235U.
- Dung dịch NaF loãng được dùng làm thuốc chống sâu răng.
4. Sản xuất flo trong công nghiệp
- Điện phân hỗn hợp KF và HF ở thể lỏng, cực dương bằng than chì, cực âm bằng thép đặc biệt hay đồng. Khí hiđro thoát ra ở cực âm, khí flo thoát ra ở cực dương.
II. BROM
1. Tính chất vật lí và trạng thái tự nhiên
- Ở điều kiện thường, brom là chất lỏng màu đỏ nâu, dễ bay hơi. Brom và hơi brom rất độc.
- Brom ít tan trong nước, nhưng tan nhiều trong dung môi hữu cơ như etanol, benzen, xăng…
- Dung dịch của brom trong nước gọi là nước brom.
- Brom tồn tại trong tự nhiên ở dạng hợp chất với hàm lượng ít hơn clo và flo, chủ yếu là muối bromua của kali, natri, magie. Trong nước biển có một lượng rất nhỏ muối natri bromua.
2. Tính chất hóa học
- Brom là chất oxi hóa mạnh nhưng kém clo và flo.
a) Tác dụng với kim loại
- Brom oxi hóa nhiều kim loại, phản ứng tỏa nhiệt.
2Fe +3Br2 ⟶ 2FeBr3 (Sắt(III) Bromua)
2Na + Br2 ⟶ 2NaBr (Natri Bromua)
b) Tác dụng với hiđro
- Phản ứng không gây nổ, khi đun nóng phản ứng cũng tỏa nhiệt, nhưng ít hơn so với phản ứng của clo.
H2 + Br2 ⟶ 2HBr
ΔH = −71,98 kJ
c) Tác dụng với nước
- Phản ứng khó khăn hơn so với phản ứng của clo.
![]()
d) Tác dụng với dung dịch muối Iot:
- Brom oxi hóa được ion I−.
![]()
e) Tác dụng với chất oxi hóa mạnh
- Brom thể hiện tính khử khi tác dụng với chất oxi hóa mạnh.
![]()
→ Br2 : Thể hiện tính khử.
→ Cl2 : Thể hiện tính oxi hóa.
3. Ứng dụng
- Brom được dùng để sản xuất một số dẫn xuất ứng dụng trong công nghiệp dược phẩm.
- Dùng chế tạo bạc bromua (AgBr) là chất nhạy cảm với ánh sáng để tráng lên phim ảnh.
- Hợp chất của brom được dùng nhiều trong công nghiệp dầu mỏ, hóa chất cho nông nghiệp, phẩm nhuộm và những hóa chất trung gian.
4. Sản xuất brom trong công nghiệp
- Brom được sản xuất từ nước biển. Sau khi tách NaCl ra khỏi nước biển, dung dịch còn lại có hòa tan NaBr. Dùng khí clo oxi hóa NaBr để sản xuất Br2
Cl2 + 2NaBr ⟶ 2NaCl + Br2
III. IOT
1. Tính chất vật lí và trạng thái tự nhiên
- Ở điều kiện thường, iot là chất rắn dạng tinh thể màu tím đen có vẻ sáng kim loại.
- Khi đun nóng nhẹ ở áp suất khí quyển, iot không nóng chảy mà biến thành hơi màu tím, khi làm lạnh hơi iot lại chuyển thành tinh thể, không qua trạng thái lỏng. Hiện tượng này gọi là sự thăng hoa.
- Iot tan rất ít trong nước tạo dung dịch gọi là nước iot; iot tan nhiều trong các dung môi hữu cơ như xăng, benzen…
- Trong tự nhiên, iot tồn tại dạng hợp chất là muối iotua, có trong một số loài rong biển, tuyến giáp của người.
2. Tính chất hóa học
- Iot có tính oxi hóa yếu hơn brom, clo, flo.
a) Tác dụng với kim loại
- Iot oxi hóa được nhiều kim loại, nhưng phản ứng chỉ xảy ra khi đun nóng hoặc có chất xúc tác.
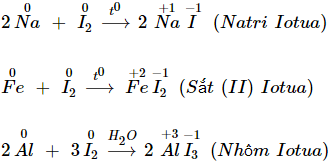
b) Tác dụng với hiđro
- Iot tác dụng với hiđro ở nhiệt độ cao và có chất xúc tác, phản ứng thuận nghịch.
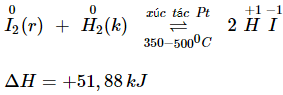
c) Tác dụng với hồ tinh bột
- Iot có tính chất đặc trưng là tác dụng với hồ tinh bột tạo thành hợp chất có màu xanh.
⟹ Hồ tinh bột là thuốc thử để nhận biết iot và ngược lại.
3. Ứng dụng
- Iot được dùng để sản xuất dược phẩm, thuốc sát trùng, chất tẩy rửa, muối iot để phòng bệnh bướu cổ do thiếu iot…
4. Sản xuất iot trong công nghiệp
- Trong công nghiệp, iot được sản xuất từ rong biển.
* KẾT LUẬN
- Tính oxi hóa của F2 > Cl2 > Br2 > I2
- Tính axit của HF < HCl < HBr < HI
Xem thêm Giải Hóa 10: Bài 25. Flo - Brom - Iot
Từ khóa » Hóa Bài 25 Lớp 10
-
Giải Hóa 10 Bài 25: Flo - Brom - Iot | Hay Nhất Giải Bài Tập Hóa Học 10
-
Giải Hóa 10 Bài 25: Flo - Brom - Iot
-
Bài 25. Flo - Brom - Iot
-
Giải Bài Tập Hóa 10 Bài 25: Flo - Brom - Iot
-
Soạn Hoá Học 10 Bài 25: Flo Brom Iot
-
Giải Bài 25 Hóa Học 10: Flo Brom Iot - Tech12h
-
Hoá Học 10 Bài 25: Flo - Brom - Iot
-
Giải Hoá 10 Bài 25: Flo - Brom - Iot SGK Trang 113 - 114
-
Hóa Học Lớp 10 - Bài 25 - Flo - Brom - Iốt - Tiết 1 - YouTube
-
Lý Thuyết Hóa 10 Bài 25: Flo – Brom – Iot
-
Hóa Học Lớp 10 - Bài 25 - Flo - Brom - Iốt - Tiết 1 2023
-
Hóa Học Lớp 10 - Bài 25 - Flo - Brom - Iốt - Tiết 2
-
Giải Bài Tập SGK Hóa Học 10 Bài 25: Flo - Brom - Iot
-
Giáo án Hóa Học 10 Bài 25 Flo – Brom – Iot - Ôn Luyện