Lý Thuyết Hóa 11: Bài 41. Phenol - TopLoigiai
Có thể bạn quan tâm
Lý thuyết Hóa 11 Bài 41. Phenol

1. Định nghĩa
Khi thay thế nguyên tử HH trong vòng benzen bằng nhóm −OH ta được phenol.
Cần phân biệt phenol (nhóm −OH đính trực tiếp vào vòng benzen) và ancol thơm (nhóm −OH đính vào mạch nhánh của vòng benzen).
Phenol là những hợp chất hữu cơ trong phân tử có nhóm −OH liên kết trực tiếp với nguyên tử cacbon của vòng benzen. Chất tiêu biểu là phenol thường (gọi tắt là phenol).
2. Phân loại
Dựa theo số nhóm −OH trong phân tử, các phenol được phân loại thành:
a, Phenol đơn chức: Phân tử có một nhóm −OH phenol.
Ví dụ:
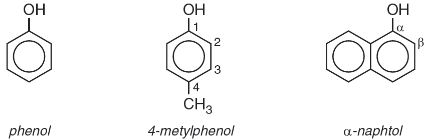
b, Phenol đa chức: Phân tử có hai hay nhiều nhóm −OH phenol.
Ví dụ:
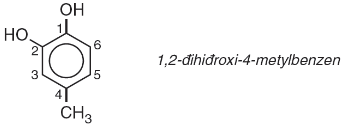
3. Cấu tạo
Phenol có công thức phân tử C6H6O và có công thức cấu tạo C6H5OH hoặc
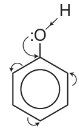
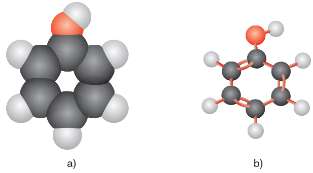
Mô hình phân tử phenol dạng đặc (a) và dạng rỗng (b)
4. Tính chất vật lí
Ở điều kiện thường, phenol là chất rắn, không màu, nóng chảy ở 43oC. Để lâu, phenol chuyển thành màu hồng do bị oxi hoá chậm trong không khí.
Phenol rất độc. Khi dây vào tay, nó gây bỏng da, do đó khi sử dụng phenol phải hết sức cẩn thận.
Phenol rất ít tan trong nước lạnh, nhưng tan nhiều trong nước nóng và trong etanol.
5. Tính chất hoá học
a, Tính chất axit
Tác dụng với kim loại kiềm và bazơ kiềm:
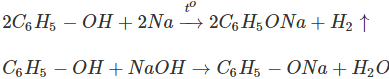
Như vậy, phenol có tính axit rõ rệt, nhưng tính axit rất yếu (yếu hơn H2CO3), không làm đổi màu quỳ tím, bị CO2 đẩy ra khỏi muối phenolat.
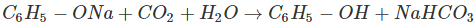
b, Phản ứng ở vòng benzen
Tác dụng với brom:
- Khi cho nước brom vào dung dịch phenol, thấy xuất hiện ngay kết trắng của 2,4,6-tribromphenol:
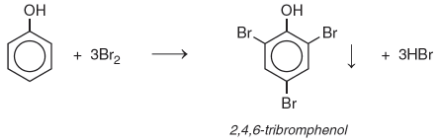
Nhờ phản ứng này có thể phát hiện lượng rất nhỏ phenol.
Tương tự bezen, phenol có thể cộng hiđrô tạo thành xiclohaxenol:
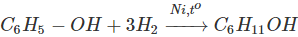
6. Điều chế
Trong công nghiệp, hiện nay phenol được điều chế bằng cách oxi hoá cumen (isopropylbenzen) nhờ oxi không khí, sau đó thuỷ phân trong dung dịch H2SO4 loãng. Sản phẩm thu được gồm phenol và axeton. Đun nóng cho axeton bay hơi rồi ngưng tụ hơi thu lấy axeton, còn lại là phenol.
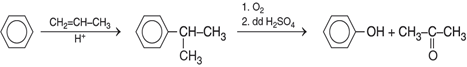
Phenol cũng có thể được điều chế từ benzen theo sơ đồ:
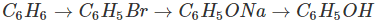
Ngoài ra, một lượng đáng kể phenol được tách ra từ nhựa than đá trong quá trình luyện cốc.
7. Ứng dụng
Phenol là nguyên liệu sản xuất nhựa phenol-fomanđehit hay poli(phenol- fomanđehit) dùng chế tạo các đồ dân dụng; nhựa ure-fomanđehit dùng làm chất kết dính (như keo dán gỗ, dán kim loại, sành, sứ...).
Phenol còn được dùng để sản xuất phẩm nhuộm, thuốc nổ (2,4,6-trinitrophenol),
chất diệt cỏ 2,4-D
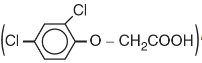
, chất diệt nấm mốc (nitrophenol),...
Xem thêm Giải Hóa 11: Bài 41. Phenol
Từ khóa » Tóm Tắt Lý Thuyết Phenol
-
Tóm Tắt Lý Thuyết Hóa Học 11: Phenol - 123doc
-
Lý Thuyết Phenol (mới 2022 + Bài Tập) - Hóa Học 11
-
Hoá Học 11 Bài 41: Phenol
-
Lý Thuyết Phenol | SGK Hóa Lớp 11
-
Lý Thuyết Tính Chất Của Phenol - Hoá Học Lớp 11 - Haylamdo
-
Lí Thuyết Về Phenol - Học Hóa Online
-
Tóm Tắt Lý Thuyết Hóa Vô Cơ Lớp 11 - Chương VIII: Dẫn Xuất Halogen
-
Chuyên đề 3 Tóm Tắt Lý Thuyết Ancol - Phenol - Thư Viện Đề Thi
-
Tổng Hợp Kiến Thức Hóa 11 Phần Dẫn Xuất Hiđrocacbon Ngắn ...
-
Tính Chất Của Phenol: Tính Chất Hóa Học, Vật Lí, Điều Chế, Ứng Dụng ...
-
Tóm Tắt Lý Thuyết Hóa Hữu Cơ 11 - Hocmai
-
Lí Thuyết Phenol
-
Hoá Học 11 Bài 41: Phenol
-
Phenol - Chuyên đề Môn Hóa Học Lớp 11