Phương Pháp Bảo Toàn Electron - Dạng Bài Tập Thường Gặp Trong đề ...
Có thể bạn quan tâm
1, Cơ sở và đặc điểm của phương pháp bảo toàn electron
- Trong phản ứng oxh-khử: ∑ne cho = ∑ ne nhận
⇒ Áp dụng cho các bài toán
+) Có xảy ra phản ứng oxh-khử
+) Có mối liên hệ giữa các chất ban đầu và sản phẩm oxh-khử
VD: hh KL + HNO3 → hh ( NO, NO2,…)
→ ne(KL cho) = ∑ htri . nKL = ne( N+ nhận) = 3nNO + nNO2 +….
Một số ví dụ minh họa
Câu 1: Nung m gam bột Fe trong ôxi thu được 3 gam hỗn hợp chất rắn X. Hoà tan hết hỗn hợp X bằng HNO3 dư, thu được 0,56 lít khí NO (đktc) là sản phẩm khử duy nhất. Giá trị m gam là:
A. 2,62. B. 2,32 . C. 2,22. D. 2,52.
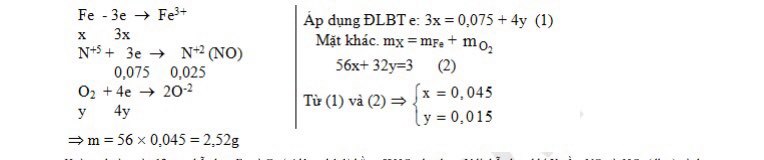
Câu 2: Hoà tan hoàn toàn 12 gam hỗn hợp Fe và Cu ( tỉ lệ mol 1:1) bằng HNO3 thu được V lít hỗn hợp khí X gồm NO và NO2 (đktc) và dung dịch Y ( chỉ chứa 2 muối và axit dư). Tỉ khối của X so với H2 bằng 19. Giá trị V lít là:
A. 2,24 B. 3,36. C. 4,48. D. 5.60.
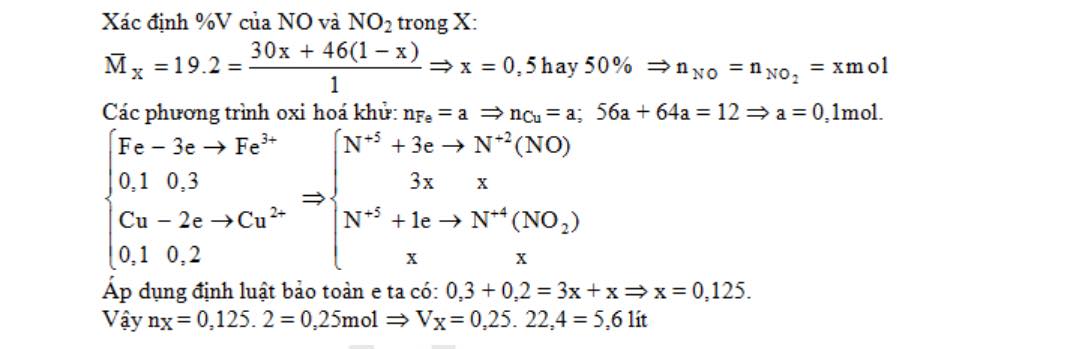
Câu 3: Cho m gam Al tan hoàn toàn dung dịch HNO3 nóng dư thu được 11,2 lít (đktc) hỗn hợp khí A gồm: N2, NO, N2O có tỉ lệ về số mol tương ứng là 2:1:2. Giá trị m gam là:
A. 35,1. B. 18,9. C. 27,9. D. 26,1.

Câu 4: Để m gam bột sắt ngoài không khí 1 thời gian thu được 11,8 gam hỗn hợp các chất rắn FeO,Fe2O3 , Fe, Fe3O4 . Hoà tan hoàn toàn hỗnhợp đó bằng dung dịch HNO3 loãng thu được 2,24 lít khí NO duy nhất (đktc). Giá trị m gam là:
A. 9,52 gam. B. 9,94 gam. C. 8,96 gam. D. 8,12 gam.

Câu 5: Hoà tan hoàn toàn 43,2 gam kim loại Cu vào dung dịch HNO3 loãng dư, tất cả khí NO thu được đem ôxi hoá thành NO2 rồi sục vào nước có dòng oxi để chuyển hết thành dung dịch HNO3 . V lít khí O2 đktc tham gia vào quá trình trên là:
A. 15,12 lít. B. 7,56 lít. C. 6,72 lít. D. 8,96 lít.
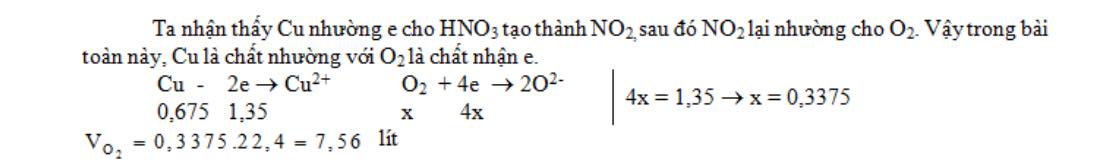
Bài tập tự áp dụng
Bài 1:Cho 3 kim loại Al, Fe, Cu vào 2 lít dung dịch HNO3 phản ứng vừa đủ thu được 1,792 lít khí X (đktc) gồm N2 và NO2 có tỉ khối hơi so với He bằng 9,25. Nồng độ mol của HNO3 trong dung dịch đầu là:
A. 0,28 M B. 1,4 M C. 1,7 M D. 1,2 M
Bài 2: Hoà tan hoàn toàn 1,08 gam Al bằng dung dịch HNO3 dư, sản phẩm ứng thu được 0,336 lít khí X (sản phẩm khử duy nhất ở đktc). Côngthức phân tử của X là
A. NO B. N2O C. NO2 D.N2
Bài 3: Hòa tan hoàn toàn 12 gam hỗn hợp Fe, Cu (tỉ lệ mol 1:1) bằng axit HNO3 , thu được V lít (đktc) hỗn hợp khí X (gồm NO và NO2 ) và dung dịch Y (chỉ chứa hai muối và axit dư). Tỉ khối của X đối với H2 bằng 19. Giá trị của V là
A. 2,24 lít. B. 4,48 lít. C. 5,60 lít. D. 3,36 lít.
Bài 4: Nung 1,92 gam hỗn hợp X gồm Fe và S trong bình kín không có không khí, sau một thời gian được chất rắn Y. Hòa tan hết Y trong dung dịch HNO3 đặc, nóng dư thu được dung dịch Z và V lít khí thoát ra(đktc). Cho Z tác dụng với dung dịch BaCl2 được 5,825 gam kết tủa. Giá trị của V là:
A. 3,136 lít. B. 4,704 lít. C. 1,568 lít. D. 1,344 lít
Bài 5: Hoà tan hoàn toàn hỗn hợp 7,32 gam gồm 5,4 gam Ag và còn lại là Cu và dung dịch HNO3 thu đựơc hỗn hợp khí X gồm NO và NO2 có tỷ lệ số mol tương ứng là 2:3. Thể tích hỗn hợp khí X ở đktc là:
A. 2,737 lít B. 1,369 lít C. 2,224 lít D. 3,3737 lít
Xem thêm:
Phương pháp tăng giảm khối lượng – Dạng bài tập thường gặp trong đề thi
Phương pháp bảo toàn nguyên tố – Dạng bài tập thường gặp trong đề thi
Từ khóa » Dl Bảo Toàn E
-
Phương Pháp Bảo Toàn E Là Gì? Định Luật Bảo Toàn Electron
-
Phương Pháp Bảo Toàn Electron Hay, Chi Tiết | Hóa Học Lớp 10
-
Phương Pháp Bảo Toàn Electron - Hóa 10 - Thầy Đặng Xuân Chất
-
Định Luật Bảo Toàn Electron Là Gì? - LaGi.Wiki
-
[PDF] Phương Pháp 5: Bảo Toàn Electron
-
Giải Bài Tập Hóa Bằng Phương Pháp Bảo Toàn Electron
-
Phương Pháp Giải Một Số Bài Toán áp Dụng định Luật Bảo Toàn Electron
-
Áp Dụng định Luật Bảo Toàn Electron Giải Bài Tập Hóa Học Vô Cơ
-
Bài Tập định Luật Bảo Toàn Electron - Tài Liệu ôn Tập Môn Hóa Học Lớp ...
-
Chuyên đề Bài Toán áp Dụng định Luật Bảo Toàn Electron
-
Bài Tập Hóa Học định Luật Bảo Toàn Electron
-
Hướng Dẫn Học Sinh Lớp 9 áp Dụng định Luật Bảo Toàn Electron Trong ...
-
Khái Quát Chung Về Phương Pháp Bảo Toàn Electron